Катаболизм глюкозы в клетке может проходить как в аэробных, так и в анаэробных условиях, его основная функция — это синтез АТФ.
В аэробных условиях глюкоза окисляется до СО2 и Н2О. Суммарное уравнение:
Этот процесс включает несколько стадий:
1. Аэробный гликолиз — процесс окисления глюкозы до 2 молекул ПВК, с образованием 2 молекул АТФ и 2 молекул НАДН2;
2. Превращение 2 молекул ПВК в 2 молекулы ацетил-КоА с выделением 2 молекул СО2 и образованием 2 молекул НАДН2;
3. Окисление 2 молекул ацетил-КоА в ЦТК с выделением 4 молекул СО2, образованием 2 молекул ГТФ (дают 2 АТФ), 6 молекул НАДН2 и 2 молекул ФАДН2;
4. Реакции окисления 6 молекулами О2 10 (8) молекул НАДН2, 2 (4) молекул ФАДН2 с выделением 6 молекул Н2О и синтезом 34 (32) молекул АТФ в дыхательной цепи окислительного фосфорилирования.
В результате аэробного окисления глюкозы образуется 38 (36) молекул АТФ, из них: 4 АТФ в реакциях субстратного фосфорилирования, 34 (32) АТФ в реакциях окислительного фосфорилирования. Если свободную энергию полного распада глюкозы 2880 кДж/моль сравнить с энергией гидролиза высокоэнергетических связей 38 моль АТФ (38 моль АТФ * 50 кДж на моль АТФ = 1900 кДж), то КПД аэробного окисления составит 65%.
Катаболизм глюкозы без кислорода идет в анаэробном гликолизе и ПФШ (ПФП). В ходе анаэробного гликолиза происходит окисления молекулы глюкозы до 2 молекул молочной кислоты с образованием 2 молекул АТФ. В анаэробных условиях гликолиз является единственным источником энергии. Суммарное уравнение: С6Н12О6 + 2Н3РО4 + 2АДФ → 2С3Н6О3 + 2АТФ + 2Н2О.
Гликолиз – главный путь катаболизма глюкозы (фруктозы и галактозы). Все его реакции протекают в цитозоле.
Аэробный гликолиз — это процесс окисления глюкозы до ПВК, протекающий в присутствии О2.
Анаэробный гликолиз – это процесс окисления глюкозы до лактата, протекающий в отсутствии О2.
Анаэробный гликолиз отличается от аэробного только наличием последней 11 реакции, первые 10 реакций у них общие.
В любом гликолизе можно выделить 2 этапа. 1 этап подготовительный, в нем затрачивается 2 молекулы АТФ. Глюкоза фосфорилируется и расщепляется на 2 фосфотриозы. 2 этап, сопряжён с синтезом АТФ. На этом этапе фосфотриозы превращаются в ПВК. Энергия этого этапа используется для синтеза 10 молекул АТФ в аэробных условиях или 4 молекул АТФ в анаэробных условиях.
1. Гексокиназа (гексокиназа II, АТФ: гексозо-6-фосфотрансфераза) в мышцах фосфорилирует в основном глюкозу, меньше – фруктозу и галактозу. Кm
Глюкокиназа (гексокиназа IV, АТФ: глюкозо-6-фосфотрансфераза) фосфорилирует глюкозу. Кm — 10 ммоль/л, активна в печени, почках. Не ингибируется глюкозо-6-ф. Индуктор инсулин. Гексокиназы осуществляют фосфорилирование гексоз.
2. Фосфогексозоизомераза (глюкозо-6ф-фруктозо-6ф-изомераза) осуществляет альдо-кетоизомеризацию открытых форм гексоз.
3. Фосфофруктокиназа 1 (АТФ: фруктозо-6ф-1-фосфотрансфераза) осуществляет фосфорилирование фруктозы-6ф. Реакция необратима и самая медленная из всех реакций гликолиза, определяет скорость всего гликолиза. Активируется: АМФ, фруктозо-2,6-дф (мощный активатор, образуется с участием фосфофруктокиназы 2 из фруктозы-6ф), фруктозо-6-ф, Фн. Ингибируется: глюкагоном, АТФ, НАДН2, цитратом, жирными кислотами, кетоновыми телами. Индуктор реакции инсулин.
4. Альдолаза А (фруктозо-1,6-ф: ДАФ-лиаза). Альдолазы действуют на открытые формы гексоз, имеют 4 субъединицы, образуют несколько изоформ. В большинстве тканей содержится Альдолаза А. В печени и почках – Альдолаза В.
5. Фосфотриозоизомераза (ДАФ-ФГА-изомераза).
6. 3-ФГА дегидрогеназа (3-ФГА: НАД + оксидоредуктаза (фосфорилирующая)) состоит из 4 субъединиц. Катализирует образование макроэргической связи в 1,3-ФГК и восстановление НАДН2, которые используются в аэробных условиях для синтеза 8 (6) молекул АТФ.
7. Фосфоглицераткиназа (АТФ: 3ФГК-1-фосфотрансфераза). Осуществляет субстратное фосфорилирование АДФ с образованием АТФ.
В следующих реакциях низкоэнергетический фосфоэфир переходит в высокоэнергетический фосфат.
8. Фосфоглицератмутаза (3-ФГК-2-ФГК-изомераза) осуществляет перенос фосфатного остатка в ФГК из положения 3 положение 2.
9. Енолаза (2-ФГК: гидро-лиаза) отщепляет от 2-ФГК молекулу воды и образует высокоэнергетическую связь у фосфора. Ингибируется ионами F — .
10. Пируваткиназа (АТФ: ПВК-2-фосфотрансфераза) осуществляет субстратное фосфорилирование АДФ с образованием АТФ. Активируется фруктозо-1,6-дф, глюкозой. Ингибируется АТФ, НАДН2, глюкагоном, адреналином, аланином, жирными кислотами, Ацетил-КоА. Индуктор: инсулин, фруктоза.
Образующаяся енольная форма ПВК затем неферментативно переходит в более термодинамически стабильную кетоформу. Данная реакция является последней для аэробного гликолиза.
Дальнейший катаболизм 2 молекул ПВК и использование 2 восстановленных НАДН2 зависит от наличия кислорода.
В аэробных условиях ПВК и водороды с НАДН2 транспортируются в матрикс митохондрий.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Увлечёшься девушкой-вырастут хвосты, займёшься учебой-вырастут рога 9510 — 

95.83.2.240 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Катаболизм глюкозы – основной поставщик энергии для большинства клеток организма.
Аэробный распад протекает в условиях достаточного снабжения тканей кислородом. Он включает несколько стадий:
1. Аэробный распад глюкозы до двух молекул пирувата в гиалоплазме клеток,который можно разделить на 2 этапа:
а)подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз.
б) основной этап, сопряженный с синтезом АТФ. В результате серии реакций фосфотриозы превращаются в пируват.
Превращение пирувата в ацетил-КоА и окисление последнего в цикле Кребса
Глюкозо-6-фосфат, образованный в результате фосфорилирования глюкозы с учас-тием АТФ, в ходе следующей реакции превращается в фруктозо-6-фосфат. Это обратимая реакция изомеризации протекает при участии глюкозофосфатизомеразы. Затем следует еще одна реакция фосфорилирования за счет АТФ, катализирует ее фосфофруктокиназа. В ходе этой реакции фруктозо-6-фосфат превращается в фруктозо-1,6-бисфосфат. Этот метаболит далее расщепляется на 2 триозофосфата: фосфоглицериноый альдегид (ФГА) и диоксиацетонфосфат (ДОАФ), реакцию катализирует альдолаза. В последующих реакциях гликолиза используется только ФГА, поэтому ДОАФ превращается с участием фермента триозофосфатизомеразы в ФГА. На этом подготовительный этап заканчивается.
Основной этап аэробного распада включает реакции, связанные с синтезом АТФ. Сна-чала происходит окисление ФГАпри участии ФГА-дегидрогеназы. Этот фермент является НАД + -зависимымым. Восстановленный НАД + затем окисляется в дыхательной цепи (перенос НАДН в митохондрии, где находится дыхательная цепь, происходит при участии челночных механизмов, это связано с тем, что митохондриальная мембрана непроницаема для НАДН). Кроме того, свободная реакция окисления этой реакции концентрируется в макроэргической связи продукта реакции. Продуктом реакции является 1,3-бисфосфоглицерат. Для фосфорилирования используется Н3РО4. В следующей реакции высокоэнергетический фосфат передается на АДФ с образованием АТФ. Катализирует реакцию фосфоглицераткиназа. АТФ в данной реакции образуется путем субстратного фосфорилирования. Продуктом реакции является 3-фосфоглицерат. В следующей реакции происходит перенос фосфата из 3 положения во второе с образованием 2-фосфоглицерата. Из него при отщеплении воды образуется фосфоенолпируват – макроэргическое соединение, фосфатная группа которого в следующей реакции переносится на АДФ с образованием АТФ при участии пируваткиназы (это вторая реакция субстратного фосфорилирования). Продуктом реакции является пируват.
Во второй стадии пируват превращается в ацетил-КоА, который сгорает в цикле Кребса и дыхательной цепи (третья стадия) до СО2 и Н2О.
Всего при аэробном окислении глюкозы выделяется 32 АТФ.
Анаэробный гликолиз представляет собой распад глюкозы в анаэробных условиях (условиях недостаточного снабжения кислородом), поэтому он не зависит от работы митохондриальной дыхательной цепи. АТФ в гликолизе образуется путем субстратногофосфорилирования. Конечным продуктом является лактат (рис. 5).
Все реакции анаэробного гликолиза (11 реакций) протекают в гиалоплазме. Первые 10 реакций до пирувата идентичны аэробному распаду. В последней реакции происходит восстановление пирувата в лактат цитозольным НАДН. Реакцию эту катализирует лактатдегидрогеназа. С помощью этой реакции обеспечивается регенерация НАД + из НАДН без участия дыхательной цепи в ситуациях, связанных с недостаточным снабжением клеток кислородом. Роль акцептора водорода от НАДН (подобно кислороду в дыхательной цепи) выполняет пируват. Таким образом, значение реакции восстановления пирувата заключается не в образовании лактата, а в том, что данная цитозольная реакция обеспечивает регенерацию НАД + . К тому же лактат не является конечным продуктом метаболизма, удаляемым из организма (лактат – тупиковый метаболит). Он выводится в кровь и утилизируется: либо превращается в глюкозу (75%), либо при доступности кислорода окисляется до СО2 и Н2О (25%).
Энергетический выход анаэробного гликолиза составляет 2 АТФ.
Недостатками анаэробного гликолиза являются: малый энергетический выход по сравнению с аэробным распадом и накопление лактата, что приводит к ацидозу, усталости.
Достоинства гликолиза: он полезен при выполнении кратковременной работы, является единственным источником энергии для эритроцитов (в них отсутствуют митохондрии), а также необходим в разных органах при дефиците кислорода (наложение жгута, падение давления, нарушение кровотока).
Регуляция.Регуляторными ферментами гликолиза являются: гексокиназа, фосфофруктокиназа и пируваткиназа. Аллостерическими ингибиторами являются АТФ и цитрат. Стимулирует гликолиз инсулин, а тормозят глюкагон, глюкокортикостероиды. Катехоламины тормозят гликолиз в печени и активируют в мышцах.
Некоторые ткани нуждаются в постоянном поступлении глюкозы. Когда поступление углеводов в составе пищи недостаточно, содержание глюкозы в крови некоторое время поддерживается в пределах нормы за счет расщепления гликогена в печени. Однако запасы гликогена в печени невелики, они практически полностью исчерпываются после суточного голодания. В этом случае в печени начинается глюконеогенез (ГНГ) – процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. В первую очередь это важно для головного мозга (он не может обеспечивать потребности в энергии за счет окисления жирных кислот) и эритроцитов – в них аэробный путь распада веществ невозможен из-за отсутствия митохондрий. Процесс в основном (на 90%) протекает в печени и менее интенсивно в корковом веществе почек и слизистой тонкого кишечника.
Субстратами ГНГ являются лактат, аминокислоты, глицерин. Аминокислоты включаются в ГНГ при длительном голодании или продолжительной мышечной работе. Глицерин освобождается в процессе липолиза из жировой ткани в период голодания или при
длительной физической нагрузке. Лактат – продукт анаэробного гликолиза. Его источником в покое являются эритроциты, а при работе – мышцы. Таким образом, лактат используется в глюконеогенезе постоянно. Большинство реакций глюконеогенеза протекает за счет обратимых реакций гликолиза и катализируется теми же ферментами. Однако три реакции гликолиза необратимы. На этих стадиях реакции ГНГ протекают другими путями (обходные пути ГНГ).
Первая необратимая реакция – образование из пирувата фосфоенолпирувата . В ГНГ это происходит в ходе двух реакций. Пируват в митохондриях карбоксилируется с образованием оксалоацетата при участии пируваткарбоксилазы – биотинзависимого фермента. Реакция протекает с использованием энергии АТФ. Дальнейшие превращения оксалоацетата протекают в цитозоле. Фосфоенолпируваткарбоксикиназа с затратой энергии ГТФ превращает оксалоацетат в фосфоенолпируват. Дальнейшие реакции ГНГ вплоть до образования фруктозо-1,6-бисфосфата протекают в цитозоле и катализируются гликолитическими ферментами. Затем следует еще одна необратимая реакция ГНГ, катализируемая фруктозо-1,6-бисфосфатазой, в которой происходит отщепление остатка фосфорной кислоты гидролитическим путем. Образующийся при этом фруктозо-6-фосфат гликолитическим ферментом изомеризуется до глюкозо-6-фосфата, от которого отщепляется остаток фосфорной кислоты при участии еще одного необратимо работающего фермента – глюкозо-6-фосфатазы. Образовавшаяся свободная глюкоза из клетки выходит в кровь. В ходе ГНГ расходуется 6 моль АТФ на синтез 1 моль глюкозы из пирувата или лактата.
Ключевыми ферментами ГНГ, катализирующими необратимые обходные реакции, являются: пируваткарбоксилаза, фосфоенолпируваткарбоксикиназа, фруктозо-1,6-бисфосфатаза и глюкозо-6-фосфатаза. Активируют ГНГ аллостерически АТФ и цитрат, обязательным активатором первого фермента является ацетил-КоА. ГНГ усиливают гормоны: глюкагон, глюкокортикостероиды. Тормозит ГНГ гормон покоя и сытости – инсулин.
Лактат, образовавшийся в ходе анаэробного гликолиза, не является конечным продуктом метаболизма. Использование лактата связано с его превращением в печени в пируват и с дальнейшим использованием последнего. Лактат, поступивший из интенсивно работающих мышц, выходит в кровь, а затем поступает в печень. В печени в лактатдегидрогеназной реакции лактат превращается в пируват, который включается в ГНГ, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами. Эту последовательность событий называют «глюкозо-лактатным циклом», или «циклом Кори». Цикл Кори выполняет две важнейшие функции: обеспечивает утилизацию лактата и предотвращает лактатацидоз. Часть пирувата, образовавшегося из лактата (25%), окисляется печенью до СО2 и Н2О с освобождением энергии.
источник
В клетках глюкоза может превращаться в жирные кислоты, аминокислоты, гликоген и окисляться в различных катаболических путях.
Окисление глюкозы называют гликолизом. Глюкоза может окисляться до лактата и до пирувата. В аэробных условиях главным продуктом является пируват, такой путь называется аэробным гликолизом. При недостатке кислорода преобладает продукт — лактат. Этот путь окисления называется анаэробным гликолизом.
Процесс аэробного распада глюкозы можно разделить на три части: специфические для глюкоза превращения, завершающиеся образованием пирувата (аэробный гликолиз); общий путь катаболизма (окислительное декарбоксилирование и ЦЛК); дыхательная цепь.
В результате этих процессов глюкоза распадается до CO2 и H2O, а освобождающаяся энергия используется для синтеза АТФ.
Распад глюкозы до пирувата также можно разделить на два этапа. Первый этап (глюкоза глицеральдегидфосфат) требует энергии в форме АТФ (2 АТФ).
Е1 — гексокиназа или глюкокиназа
Второй этап (глицеральдегид пируват) протекает с выходом энергии в виде АТФ и НАДН (4 АТФ и 2 НАДН).
Особенности ферментов гликолиза.
На пути гликолиза три реакции являются необратимыми (реакция 1 —глюкокиназная, реакция 3 — фофофруктокиназная, реакция 10 —пируваткиназная). Они катализируются регуляторными ферментами и определяют скорость всего процесса гликолиза. Кроме того, именно эти реакции отличаются от реакций обратного пути — синтеза глюкозы (глюконеогенеза).
Гексокиназа и глюкокиназа
Глюкокиназная реакция — первая АТФ-зависимая реакция гликолиза. Она катализируется тканеспецифическими ферментами — гексокиназами.У человека известно 4 изомера гексокиназ (типы I — IV). Изофермент IV типа — глюкокиназа. Глюкокиназа находится только в печени и имеет высокое значение Км к глюкозе. Это приводит к тому, что фермент насыщается субстратом лишь при очень высоких концентрациях глюкозы. Гексокиназа катализирует фосфорилирование глюкозы при любых (в том числе низких) концентрациях глюкозы и ингибируется продуктом глюкозо-6-фосфатом. Глюкокиназа не ингибируется глюкозо-6-фосфатом. При увеличении концентрации глюкозы после приема пищи увеличивается скорость глюкокиназной реакции. Глюкозо-6-фосфат не проходит через клеточные мембраны и задерживается в клетке, поэтому больше глюкозы задерживается в печени. Таким образом, глюкокиназа является буфером глюкозы в крови. В тоже время, в тканях, энергетический обмен которых зависит от глюкозы, локализован изофермент с низким значением Км.
Фермент имеет почти равное значение Км для глюкозо-6-фосфата и фруктозо-6-фосфата. Этот фермент по-другому называют гексозофосфатизомераза. Катализирует реакции гликолиза и глюконеогенеза.
Этот фермент катализирует только прямую реакцию, т.е. эта реакция гликолиза является необратимой и определяет скорость всего процесса.
Фруктозодифосфатальдолаза катализирует реакции гликолиза и глюконеогенеза.
Триофосфатизомераза катализирует равновесную реакцию, и равновесие смещается в сторону гликолиза или глюконеогенеза по принципу действия масс.
Глицеральдегид-3-фосфатдегидрогеназа катализирует реакции гликолиза и глюконеогенеза.
Фосфоглицераткиназа катализирует обратимую реакцию (гликолиза и глюконеогенеза). Эта реакция имеет большое значение в эритроцитах, т.к. образующийся 1,3-дифосфоглицерат под действием фермента дифосфоглицератмутазы превращается в 2,3-дифосфоглицерат (ДФГ) — регулятор сродства Hb к кислороду.
Фосфоглицератфосфомутаза и енолгидратаза катализируют превращение относительно низкоэнергетической связи в 3-фосфоглицерате в высокоэнергетическую форму, а затем в АТФ.
Пируваткиназа — регуляторный фермент, который катализирует необратимую реакцию, в которой высокоэнергетический фосфат фосфоенолпирувата превращается в АТФ.
Пируват далее окисляется в митохондриях. Распад глюкозы до пирувата протекает в цитоплазме, поэтому существует специальный переносчик пирувата в митохондрии по механизму симпорта с Н + . Образующийся НАДН также должен быть транспортирован в митоходрии для окисления в цепи переноса электронов.
источник
Чтобы понять, что такое гликолиз, придется обратиться к греческой терминологии, потому что данный термин произошел от греческих слов: гликос – сладкий и лизис – расщепление. От слова Гликос происходит и название глюкозы. Таким образом, под данным термином подразумевается процесс насыщения глюкозы кислородом, в результате которого одна молекула сладкого вещества распадается на две микрочастицы пировиноградной кислоты. Гликолиз – это биохимическая реакция, происходящая в живых клетках, и направленная на расщепление глюкозы. Существует три варианта разложения глюкозы, и аэробный гликолиз – один из них.
Процесс этот состоит из целого ряда промежуточных химических реакций, сопровождаемых выделением энергии. В этом и кроется основная суть гликолиза. Высвобождаемая энергия расходуется на общую жизнедеятельность живого организма. Общая формула расщепления глюкозы выглядит так:
Глюкоза + 2НАД + + 2АДФ + 2Pi → 2 пируват + 2НАДH + 2Н + + 2АТФ + 2Н2O
Аэробное окисление глюкозы с последующим расщеплением ее шестиуглеродной молекулы осуществляется посредством 10 промежуточных реакций. Первые 5 реакций, объединяет подготовительная фаза подготовки, а последующие реакции направлены на образование АТФ. В ходе реакций образуются стереоскопические изомеры сахаров и их производные. Основное накопление энергии клетками происходит во второй фазе, связанной с образованием АТФ.
В аэробном гликолизе выделяются 2 фазы.
Первая фаза – подготовительная. В ней глюкоза вступает в реакцию с 2 молекулами АТФ. Эта фаза состоит из 5 последовательных ступеней биохимических реакций.
Фосфорилирование, то есть процесс переноса остатков фосфорной кислоты в первой и последующих реакциях производится за счет молекул адезинтрифосфорной кислоты.
В первой ступени остатки фосфорной кислоты из молекул адезинтрифосфата переносятся в молекулярную структуру глюкозы. В ходе процесса получается глюкозо-6-фосфат. В качестве катализатора в процессе выступает гексокиназа, ускоряющая процесс с помощью ионов магния, выступающих в качестве кофактора. Ионы магния задействованы и в других реакциях гликолиза.
На 2-й ступени происходит изомеризация глюкозо-6-фосфата во фруктозу-6-фосфат.
Изомеризация – образование веществ, имеющих одинаковый вес, состав химических элементов, но обладающих разными свойствами вследствие различного расположения атомов в молекуле. Изомеризация веществ осуществляется под действием внешних условий: давления, температур, катализаторов.
В данном случае процесс осуществляется под действием катализатора фосфоглюкозоизомеразы при участии ионов Mg + .
На данной ступени происходит присоединение фосфорильной группы за счет АТФ. Процесс осуществляется при участии фермента фосфофруктокиназа-1. Этот фермент и предназначен только для участия в гидролизе. В результате реакции получаются фруктозо-1,6-бисфосфат и нуклеотид адезинтрифосфат.
АТФ – адезинтрифосфат, уникальный источник энергии в живом организме. Представляет собой довольно сложную и громоздкую молекулу, состоящую из углеводородных, гидроксильных групп, азота и групп фосфорной кислоты с одной свободной связью, собранных в нескольких циклических и линейных структурах. Высвобождение энергии происходит в результате взаимодействия остатков фосфорной кислоты с водой. Гидролиз АТФ сопровождается образованием фосфорной кислоты и выделением 40-60 Дж энергии, которую организм затрачивает на свою жизнедеятельность.
Но прежде должно произойти фосфорилирование глюкозы за счет молекулы Адезинтрифосфата, то есть перенос остатка фосфорной кислоты в глюкозу.
В четвертой реакции фруктозо-1,6-дифосфат распадается на два новых вещества.
- Диоксиацетонфосфат,
- Глицеральд альдегид-3-фосфат.
В данном химическом процессе в качестве катализатора выступает альдолаза, фермент, участвующий в энергетическом обмене, и необходимый при диагностировании ряда заболеваний.
И, наконец, последний процесс – изомеризация триозофосфатов.
Глицеральд-3-фосфат продолжит участвовать в процессе аэробного гидролиза. А второй компонент – диоксиацетон фосфат при участии фермента триозофосфатизомеразы преобразуется в глицеральдегид-3-фосфат. Но трансформация эта – обратимая.
В данной фазе гликолиза будет аккумулироваться в виде АТФ биохимическая энергия. Адезинтрифосфат образуется из адезиндифосфата за счет фосфорилирования. А также образуется НАДН.
Аббревиатура НАДН имеет очень сложную и труднозапоминаемую для неспециалиста расшифровку – Никотинамидадениндинуклеотид. НАДН – это кофермент, небелковое соединение, участвующее в химических процессах живой клетки. Он существует в двух формах:
- окисленной (NAD + , NADox);
- восстановленной (NADH, NADred).
В обмене веществ NAD принимает участие в окислительно-восстановительных реакциях транспортируя электроны из одного химического процесса в другой. Отдавая, или принимая электрон, молекула преобразуется из NAD + в NADH, и наоборот. В живом организме НАД вырабатывается из триптофана или аспартата аминокислот.
Две микрочастицы глицеральдегид-3-фосфата подвергаются реакциям, в ходе которых образуется пируват, и 4 молекулы АТФ. Но конечный выход адезинтрифосфата составит 2 молекулы, поскольку две затрачены в подготовительной фазе. Процесс продолжается.
В данной реакции происходит окисление и фосфорилирование глицеральдегид-3-фосфата. В итоге получается 1,3-дифосфоглицериновая кислота. В ускорении реакции участвует глицеральдегид-3-фосфатдегидрогеназа
Реакция происходит при участии энергии, полученной извне, поэтому она называется эндергонической. Такие реакции протекают параллельно с экзергоническими, то есть выделяющими, отдающими энергию. В данном случае такой реакцией служит следующий процесс.
В этой промежуточной реакции фосфорильная группа переносится фосфоглицераткиназой с 1,3-дифосфоглицерата на адезиндифосфат. В итоге получаются 3-фосфоглицерат и АТФ.
Фермент фосфоглицераткиназа приобрел свое название за способность катализировать реакции в обоих направлениях. Этот фермент также транспортирует фосфатный остаток с адезинтрифосфата на 3-фосфоглицерат.
6-я и 7-я реакции часто рассматриваются как единый процесс . 1,3-дифосфоглицерат в нем рассматривается как промежуточный продукт. Вместе 6-я и 7-я реакции выглядят так:
Глицеральдегид-3-фосфат+ADP+Pi +NAD+⇌3 -фосфоглицерат+ATP+NADH+Н+,ΔG′о = −12,2 кДж/моль.
И суммарно эти 2 процесса освобождают часть энергии.
Получение 2-фосфоглицерата – процесс обратимый, происходит под каталитическим действием фермент фосфоглицератмутазы. Фосфорильная группа переносится с двухвалентного атома углерода 3-фосфоглицерата на трехвалентный атом 2-фосфоглицерата, в итоге образуется 2-фосфоглицериновая кислота. Реакция проходит при участи положительно заряженных ионов магния.
Эта реакция в своей сути является второй реакцией расщепления глюкозы (первой была реакция 6-й ступени). В ней фермент фосфопируватгидратаза стимулирует отщепление воды от атома С, то есть процесс элиминирования из молекулы 2-фосфоглицерата и образование фосфоенолпирувата (фосфоенолпировиноградной кислоты).
В заключительной реакции гликолиза задействованы коферменты – калий, магний и марганец, в качестве катализатора выступает фермент пируваткиназа.
Преобразование енольной формы пировиноградной кислоты в кето-форму является обратимым процессом, и в клетках присутствуют оба изомера. Процесс перехода изометрических веществ из одного в другой называется таутомеризацией.
Наряду с аэробным гликолизом, то есть расщеплением глюкозы при участии О2 , существует и так называемый анаэробный распад глюкозы, в котором кислород не участвует. Он также состоит из десяти последовательных реакций. Но где протекает анаэробный этап гликолиза, связан ли он с процессами кислородного расщепления глюкозы, или это самостоятельный биохимический процесс, попробуем в этом разобраться.
Анаэробный гликолиз – это распад глюкозы при отсутствии кислорода с образованием лактата. Но в процессе образования молочной кислоты НАДН в клетке не накапливается. Этот процесс осуществляется в тех тканях и клетках, которые функционируют в условиях кислородного голодания – гипоксии. К таким тканям в первую очередь относятся скелетные мышцы. В эритроцитах, несмотря на наличие кислорода, тоже в процессе гликолиза образуется лактат, потому что в кровяных клетках отсутствуют митохондрии.
Анаэробный гидролиз протекает в цитозоле (жидкой части цитоплазмы) клеток и является единственным актом, продуцирующим и поставляющим АТФ, поскольку в данном случае окислительное фосфорилирование не работает. Для окислительных процессов нужен кислород, а его в анаэробном гликолизе нет.
И пировиноградная, и молочная кислоты служат источниками энергии, для выполнения мышцами определенных задач. Излишки кислот поступают в печень, где под действием ферментов снова превращаются в гликоген и глюкозу. И процесс начинается снова. Недостаток глюкозы восполняется питанием – употреблением сахара, сладких фруктов, и иных сладостей. Так что нельзя в угоду фигуре совсем отказываться от сладкого. Сахарозы нужны организму, но в меру.
источник
Аэробный и анаэробный гликолиз
Аэробный и анаэробный гликолиз являются популярными в настоящее время. Они имеют основополагающее значение для объяснения того, как организм разрушает пищу и превращает ее в энергию. Можно также услышать эти термины, упомянутые фитнес-баффами; аэробные и анаэробные упражнения важны для улучшения здоровья и благополучия. В научном выражении гликолиз включает в себя десять стадий, в течение которых моносахариды, такие как галактоза, фруктоза и глюкоза, превращаются в промежуточные вещества для подготовки к аэробному или анаэробному гликолизу.
Первый тип гликолиза, который был обнаружен, называется дорогой Эмбден-Мейерхоф-Парнас, или путь ЭМП, и считается наиболее распространенным путем, используемым организмами. Существуют также альтернативные пути, такие как путь Entner-Doudoroff. В условиях неспециалиста различные организмы используют аэробный и анаэробный гликолиз для преобразования пищи в энергию. Существуют два основных различия между этими двумя типами процессов.
Гликолиз через аэробный гликолиз происходит, когда атомы кислорода и водорода соединяются вместе для разрушения глюкозы и облегчают обмен энергией. С другой стороны, анаэробный гликолиз возникает, когда глюкоза разрушается без присутствия кислорода. Анаэробный гликолиз используется мышцами, когда кислород истощается во время тренировки, и полученная молочная кислота затем удаляется из мышечных клеток и направляется в печень, которая превращает ее обратно в глюкозу. Первое различие между аэробным и анаэробным гликолизом связано с наличием или отсутствием кислорода. Если присутствует кислород, то процесс называется аэробным; в противном случае, без кислорода, процесс становится анаэробным.
Второе различие связано с побочными продуктами каждого процесса. Аэробный гликолиз содержит углекислый газ и воду в качестве побочных продуктов, тогда как анаэробный гликолиз изгоняет побочные продукты, такие как этиловый спирт, в растениях и молочную кислоту у животных; поэтому анаэробный гликолиз иногда называют образованием молочной кислоты. Человеческое тело может разлагать глюкозу тремя способами во время тренировки. Первый — через аэробный гликолиз, второй — через систему фосфокреатина, а третий — через анаэробный гликолиз.
Аэробный гликолиз сначала используют при любой активности, при этом система фосфокреатина помогает во время деятельности, продолжающейся не более тридцати секунд. Анаэробный гликолиз начинается во время активности, которая длится долгое время — это помогает мышцам тела сжигать энергию. Однако анаэробные упражнения не должны использоваться часто, поскольку это может привести к накоплению молочной кислоты в организме, избыток которой приводит к судорогам в теле. Аэробные упражнения по-прежнему являются основным способом обучения тела адаптации к любому стрессу; он укрепляет дыхательную систему организма, уменьшает артериальное давление и эффективно сжигает жир. С другой стороны, анаэробные упражнения помогают наращивать мышечную массу и позволяют организму сжигать увеличенное количество калорий, даже находясь в состоянии покоя. Для достижения наилучших результатов, как аэробные, так и анаэробные упражнения должны быть включены в фитнес-схемы, чтобы поддерживать работоспособность организма.
источник
Основные пути катаболизма глюкозы
Катаболизм глюкозы в клетке может проходить как в аэробных, так и в анаэробных условиях, его основная функция — это синтез АТФ.
В аэробных условиях глюкоза окисляется до СО2и Н2О. Суммарное уравнение:
Этот процесс включает несколько стадий:
Аэробный гликолиз. В нем происходит окисления 1 глюкозы до 2 ПВК, с образованием 2 АТФ (сначала 2 АТФ затрачиваются, затем 4 образуются) и 2 НАДН2;
Превращение 2 ПВК в 2 ацетил-КоА с выделением 2 СО2и образованием 2 НАДН2;
ЦТК.В нем происходит окисление 2 ацетил-КоА с выделением 4 СО2, образованием 2 ГТФ (дают 2 АТФ), 6 НАДН2и 2 ФАДН2;
Цепь окислительного фосфорилирования.В ней происходит окисления 10 (8) НАДН2, 2 (4) ФАДН2с участием 6 О2, при этом выделяется 6 Н2О и синтезируется 34 (32) АТФ.
В результате аэробного окисления глюкозы образуется 38 (36) АТФ, из них: 4 АТФ в реакциях субстратного фосфорилирования, 34 (32) АТФ в реакциях окислительного фосфорилирования. КПД аэробного окисления составит 65%.
Катаболизм глюкозы без О2 идет в анаэробном гликолизе и ПФШ (ПФП).
В ходе анаэробного гликолизапроисходит окисления 1 глюкозы до 2 молекул молочной кислоты с образованием 2 АТФ (сначала 2 АТФ затрачиваются, затем 4 образуются). В анаэробных условиях гликолиз является единственным источником энергии. Суммарное уравнение: С6Н12О6+ 2Н3РО4+ 2АДФ → 2С3Н6О3+ 2АТФ + 2Н2О.
В ходе ПФПиз глюкозы образуются пентозы и НАДФН2. В ходеПФШиз глюкозы образуются только НАДФН2.
Гликолиз – главный путь катаболизма глюкозы (а также фруктозы и галактозы). Все его реакции протекают в цитозоле.
Аэробный гликолиз— это процесс окисления глюкозы до ПВК, протекающий в присутствии О2.
Анаэробный гликолиз– это процесс окисления глюкозы до лактата, протекающий в отсутствии О2.
Анаэробный гликолиз отличается от аэробного только наличием последней 11 реакции, первые 10 реакций у них общие.
В любом гликолизе можно выделить 2 этапа:
1 этап подготовительный, в нем затрачивается 2 АТФ. Глюкоза фосфорилируется и расщепляется на 2 фосфотриозы;
2 этап, сопряжён с синтезом АТФ. На этом этапе фосфотриозы превращаются в ПВК. Энергия этого этапа используется для синтеза 4 АТФ и восстановления 2НАДН2, которые в аэробных условиях идут на синтез 6 АТФ, а в анаэробных условиях восстанавливают ПВК до лактата.
Энергетический баланс гликолиза
Таким образом, энергетический баланс аэробного гликолиза:
8АТФ = -2АТФ + 4АТФ + 6АТФ (из 2НАДН2)
Энергетический баланс анаэробного гликолиза:
Общие реакции аэробного и анаэробного гликолиза
1. Гексокиназа (гексокиназа II, АТФ: гексозо-6-фосфотрансфераза) в мышцах фосфорилирует в основном глюкозу, меньше – фруктозу и галактозу. Кm + оксидоредуктаза (фосфорилирующая)) состоит из 4 субъединиц. Катализирует образование макроэргической связи в 1,3-ФГК и восстановление НАДН2, которые используются в аэробных условиях для синтеза 8 (6) молекул АТФ.
7.Фосфоглицераткиназа(АТФ: 3ФГК-1-фосфотрансфераза). Осуществляет субстратное фосфорилирование АДФ с образованием АТФ.
В следующих реакциях низкоэнергетический фосфоэфир переходит в высокоэнергетический фосфат.
8.Фосфоглицератмутаза(3-ФГК-2-ФГК-изомераза) осуществляет перенос фосфатного остатка в ФГК из положения 3 положение 2.
9.Енолаза(2-ФГК: гидро-лиаза) отщепляет от 2-ФГК молекулу воды и образует высокоэнергетическую связь у фосфора. Ингибируется ионамиF — .
10.Пируваткиназа(АТФ: ПВК-2-фосфотрансфераза) осуществляет субстратное фосфорилирование АДФ с образованием АТФ.
Активируется фруктозо-1,6-дф, глюкозой.
Ингибируется АТФ, НАДН2, глюкагоном, адреналином, аланином, жирными кислотами, Ацетил-КоА.
Индуктор: инсулин, фруктоза.
Образующаяся енольная форма ПВК затем неферментативно переходит в более термодинамически стабильную кетоформу. Данная реакция является последней для аэробного гликолиза.
Дальнейший катаболизм 2 ПВК и использование 2 НАДН2зависит от наличия О2.
источник
Промежуточный обмен глюкозы в организме
Глюконеогенез. Роль печени в углеводном обмене.
Одним из этапов обмена углеводов в организме является межуточный обмен – окисление углеводов в тканях организма до образования конечных продуктов – СО2 и Н2О. Процесс окисления Гл идет по двум основным путям:
1. Анаэробный гликолиз.
2. Аэробный гликолиз.
Распад Гл в анаэробных условиях и при непрямом превращении протекает почти одинаково до образования пировиноградной кислоты (ПК). В анаэробных условиях ПК восстанавливается в молочную кислоту (МК), которая в печени участвует в образовании гликогена или ресинтезируется через цикл Кори в Гл. В крови здоровых людей содержание МК составляет 0,6-1,7 ммоль/л.
В аэробных условиях при участии пируватдегидрогеназного комплекса и 5 коферментов (тиаминдифосфата, рибофлавина, пантотеновой и липоевой кислот, никотинамида) происходит окисление пировиноградной кислоты до ацетил-КoА, который затем подвергается дальнейшим превращениям в цикле Кребса, конечными продуктами которого является СО2 и Н2О и 38 молекул АТФ.
Основные пути метаболизма глюкозы:
Гликолиз – это серия реакций, в результате которых глюкоза распадается на 2 молекулы пирувата (аэробный гликолиз) или две молекулы лактата (анаэробный гликолиз). Все реакции гликолиза (10-11 реакций) протекают в цитозоле и характерны для всех органов и тканей.
Анаэробный гликолиз – это процесс окисления глюкозы, в результате которого происходит расщепление глюкозы с образованием 2 молекул лактата.
Главным путем распада глюкозы, ведущим к освобождению энергии, является дихотомический путь.
В реакциях этого пути получить из глюкозы энергию можно двумя путями:
1) Путем анаэробного распада глюкозы (анаэробный гликолиз) до молочной кислоты.
Многоступенчатые реакции можно выразить суммарным уравнением: глюкоза → 2лактат + 134 кДж. Часть этой энергии расходуется на образование 2 молекул АТФ, остальная рассеивается в виде тепла.
2) Путем аэробного распада глюкозы (аэробный гликолиз) до конечных продуктов – СО2 и Н2О.
Многоступенчатые реакции можно выразить суммарным уравнением: Глюкоза + 6О2 → 6СО2 + 6Н2О + 2850 кДж. При этом 60% образующейся энергии запасается в виде АТФ. Аэробный путь экономически выгоднее, при равных количествах используемой глюкозы, этот путь дает почти в 20 раз больше АТФ. Аэробный распад глюкозы осуществляется почти всеми тканями нашего организма, исключение – эритроциты, их жизнедеятельность поддерживается путем гликолиза.
Дата добавления: 2014-01-04 ; Просмотров: 6788 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Анаэробным гликолизом называют процесс расщепления глюкозы с образованием в качестве конечного продукта лактата. Этот процесс протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи. АТФ образуется за счёт реакций субстратного фосфорилирования. Суммарное уравнение процесса:
С6Н1206 + 2 Н3Р04 + 2 АДФ = 2 С3Н6О3 + 2 АТФ + 2 Н2O.
Основное физиологическое назначение катаболизма глюкозы заключается в использовании энергии, освобождающейся в этом процессе для синтеза АТФ.
Энергия, выделяющаяся в процессе полного распада глюкозы до СО2 и Н2О, составляет 2880 кДж/моль. Если эту величину сравнить с энергией гидролиза высокоэнергетических связей
— 38 моль АТФ (50 кДж на моль АТФ), то получим: 50×38 = 1900 кДж, что составляет 65% от всей энергии, выделяющейся при полном распаде глюкозы. Такова эффективность использования энергии распада глюкозы для синтеза АТФ. Необходимо учитывать, что реальная эффективность процесса может быть ниже. Точно оценить выход АТФ можно только при субстратном фосфорилировании, а соотношение между поступлением водорода в дыхательную цепь и синтезом АТФ является приблизительным.
29.
Анаэробным гликолизом называют процесс расщепления глюкозы с образованием в качестве конечного продукта лактата. Этот процесс протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи. АТФ образуется за счёт реакций субстратного фосфорилирования. Суммарное уравнение процесса:
Реакции анаэробного гликолизаПри анаэробном гликолизе в цитозоле протекают все 10 реакций, идентичных аэробному гликолизу. Лишь 11-я реакция, где происходит восстановление пирувата цитозольным NADH, является специфической для анаэробного гликолиза (рис. 7-41). Восстановление пирувата в лактат катализирует лактатдегидро-геназа (реакция обратимая, и фермент назван по обратной реакции). С помощью этой реакции обеспечивается регенерация NAD + из NADH без участия митохондриальной дыхательной цепи в ситуациях, связанных с недостаточным снабжением клеток кислородом. Роль акцептора водорода от NADH (подобно кислороду в дыхательной цепи) выполняет пируват. Таким образом, значение реакции восстановления пирувата заключается не в образовании лактата, а в том, что данная цитозольная реакция обеспечивает регенерацию NAD + . К тому же лактат не является конечным продуктом метаболизма, удаляемым из организма. Это вещество выводится в кровь и утилизируется, превращаясь в печени в глюкозу, или при доступности кислорода превращается в пируват, который вступает в общий путь катаболизма, окисляясь до СО2 и Н2О.

30. Субстратное фосфорилирование.Одним из источников нуклео-
зидтрифосфатов, главным образом АТФ, является субстратное фосфорили-
рование, в процессе которого они могут синтезироваться в реакциях переноса
фосфорильной группы от содержащих остаток фосфорной кислоты макроэр-
гических соединений на нуклеозиддифосфаты. К таким реакциям относятся
реакции гликолиза, когда с 1,3-дифосфоглицерата, содержащего макроэрги-
ческую связь в 1 положении, ферментом фосфоглицераткиназой на молекулу
АДФ переносится остаток фосфорной кислоты — образуется молекула АТФ:
И вторая реакция субстратного фосфорилирования АДФ с образовани-
ем енольной формы пирувата и АТФ, протекающая под действием фермента

формы пирувата в пируват происходит неферментативно. К реакциям субстратного фосфорилирования также относится катализируемое сукцинил-
КоА-синтетазой (сукцинилтиокиназой) образование ГТФ в цикле Кребса:
Сукцинил-СоА Сукцинат
В мышцах в процессе мышечного сокращения активно протекает еще
одна реакция субстратного фосфорилирования, катализируемая креатинфос-
фаткиназой.
Эта реакция обратима и в условиях покоя идет образование креатин-
фосфата из АТФ и креатина, а в процессе мышечной работы накопленный
креатинфосфат отдает фосфорильную группу на АДФ с образованием АТФ,
необходимого для процессов мышечного сокращения.
Реакции субстратного фосфорилирования являются важным источни-
ком получения АТФ, особенно в анаэробных условиях. Для эукариотов глав-
ным источником АТФ является окислительное фофорилирование, использу-
ющее энергию электронов, освобождающихся при дегидрировании субстра-
тов, при восстановлении кислорода, через реализацию трансмембранного
протонного градиента потенциала.
31. Биосинтез глюкозы (глюконеогенез) из аминокислот, глицерина и молочной кислоты. Взаимосвязь гликолиза в мышцах и глюконеогенеза в печени (цикл Кори).
Глюконеогенез — процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Процесс протекает в основном в печени и менее интенсивно в корковом веществе почек, а также в слизистой оболочке кишечника. Эти ткани могут обеспечивать синтез 80-100 г глюкозы в сутки. На долю мозга при голодании приходится большая часть потребности организма в глюкозе. Это объясняется тем, что клетки мозга не способны, в отличие от других тканей, обеспечивать потребности в энергии за счёт окисления жирных кислот .Кроме мозга, в глюкозе нуждаются ткани и клетки, в которых аэробный путь распада невозможен или ограничен, например эритроциты (они лишены митохондрий), клетки сетчатки, мозгового слоя надпочечников и др. Первичные субстраты глюконеогенеза — лактат, аминокислоты и глицерол. Включение этих субстратов в глюконеогенез зависит от физиологического состояния организма.
- Лактат — продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Таким образом, лактат используется в глюконеогенезе постоянно.
- Глицерол высвобождается при гидролизе жиров в жировой ткани в период голодания или при длительной физической нагрузке.
- Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе.
Большинство реакций глюконеогенеза протекает за счёт обратимых реакций гликолиза и катализируется теми же ферментами. Однако 3 реакции гликолиза термодинамически необратимы. На этих стадиях реакции глюконеогенеза протекают другими путями. Необходимо отметить, что гликолиз протекает в цитозоле, а часть реакций глюконеогенеза происходит в митохондриях.
1. Образование фосфоенолпирувата из пирувата . Образование фосфоенолпирувата из пирувата происходит в ходе двух реакций первая из которых протекает в митохондриях. Пируват, образующийся из лактата или из некоторых аминокислот, транспортируется в матрикс митохондрий и там карбоксилируется с образованием оксалоацетата.
Пируват-карбоксилаза,катализирующая данную реакцию, — митохондриальный фермент, коферментом которого является биотин. Реакция протекает с использованием АТФ.
Дальнейшие превращения оксалоацетата протекают в цитозоле. Следовательно, на этом этапе должна существовать система транспорта оксалоацетата через митохондриальную мембрану, которая для него непроницаема. Оксалоацетат в митохондриальном матриксе восстанавливается с образованием малата при участии NADH (обратная реакция цитратного цикла).
Образовавшийся малат затем проходит через митохондриальную мембрану с помощью специальных переносчиков. Кроме того, оксалоацетат способен транспортироваться из митохондрий в цитозоль в виде аспартата в ходе малат-аспартатного челночного механизма. В цитозоле малат вновь превращается в оксалоацетат в ходе реакции окисления с участием кофермента NAD + . Обе реакции: восстановление оксалоацетата и окисление малага катализируют малатдегидрогеназа, но в первом случае это митохондриальный фермент, а во втором — цитозольный. Образованный в цитозоле из ма-лата оксалоацетат затем превращается в фосфоенолпируват в ходе реакции, катализируемой фосфоенолпируваткарбоксикиназой — ГТФ-зависимым ферментом.
2. Образование глюкозы из лактата. Лактат, образовавшийся в интенсивно работающих мышцах или в клетках с преобладающим анаэробным способом катаболизма глюкозы, поступает в кровь, а затем в печень. В печени отношение NADH/NAD + ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в обратном направлении, т.е. в сторону образования пирувата из лактата. Далее пируват включается в глюконеогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами. Эту последовательность событий называют «глюкозо-лактатным циклом», или «циклом Кори«.
Цикл Кори выполняет 2 важнейшие функции: 1 — обеспечивает утилизацию лактата; 2 — предотвращает накопление лактата и, как следствие этого, опасное снижение рН (лактоацидоз). Часть пирувата, образованного из лактата, окисляется печенью до СО2 и Н2О. Энергия окисления может использоваться для синтеза АТФ, необходимого для реакций глюконеогенеза.
3. Образование глюкозы из аминокислот. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, окса-лоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах. Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.
4. Образование глюкозы из глицерола. Глицерол образуется при гидролизе триацил-глицеролов, главным образом в жировой ткани. Использовать его могут только те ткани, в которых имеется фермент глицерол киназа, например печень, почки. Этот АТФ-зависимый фермент катализирует превращение глицерола в α-глицерофосфат (глицерол-3-фосфат). При включении глицерол-3-фосфата в глюконеогенез происходит его дегидрирование NAD-зависимой дегидрогеназой с образованием дигидроксиацетонфосфата, который далее превращается в глюкозу.
32. Аэробный распад глюкозы можно выразить суммарным уравнением:
Этот процесс включает несколько стадий:
- Аэробный гликолиз — процесс окисления глюкозы с образованием двух молекул пирувата;
- Общий путь катаболизма, включающий превращение пирувата в ацетил-КоА и его дальнейшее окисление в цитратом цикле;
- ЦПЭ на кислород, сопряжённая с реакциями дегидрирования, происходящими в процессе распада глюкозы.
Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки.
Этапы аэробного гликолиза
В аэробном гликолизе можно выделить 2 этапа.
1. Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ.
2. Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.
Реакции аэробного гликолиза
Превращение глюкозо-6-фосфата в 2 молекулы глицеральдегид-3-фосфата Глюкозо-6-фосфат, образованный в результате фосфорилирования глюкозы с участием АТФ, в ходе следующей реакции превращается в фруктозо-6-фосфат. Эта обратимая реакция изомеризации протекает под действием фермента глюкозофосфатизомеразы.
Затем следует ещё одна реакция фосфорилирования с использованием фосфатного остатка и энергии АТФ. В ходе этой реакции, катализируемой фосфофруктокиназой, фруктозо-6-фосфат превращается в фруктозо-1,6-бисфосфат. Данная реакция, так же, как гексокиназная, практически необратима, и, кроме того, она наиболее медленная из всех реакций гликолиза. Реакция, катализируемая фосфофруктокиназой, определяет скорость всего гликолиза, поэтому, регулируя активность фосфофруктокиназы, можно изменять скорость катаболизма глюкозы.
Фруктозо-1,6-бисфосфат далее расщепляется на 2 триозофосфата: глицеральдегид-3-фосфат и дигидроксиацетонфосфат. Реакцию катализирует фермент фруктозобисфосфатальдолаза,или просто альдолаза.Этот фермент катализирует как реакцию альдольного расщепления, так и альдольной конденсации, т.е. обратимую реакцию. Продукты реакции альдольного расщепления — изомеры. В последующих реакциях гликолиза используется только глицеральдегид-3-фосфат, поэтому дигидроксиацетонфосфат превращается с участием фермента триозофосфатизомеразы в глицероальдегид-3-фосфат. В описанной серии реакций дважды происходит фосфорилирование с использованием АТФ. Однако расходование двух молекул АТФ (на одну молекулу глюкозы) далее будет компенсировано синтезом большего количества АТФ
Превращение глицеральдегид-3-фосфата в пируват Эта часть аэробного гликолиза включает реакции, связанные с синтезом АТФ. Наиболее сложной в данной серии реакций является реакция превращения глицеральдегид-3-фосфата в 1,3-бисфосфоглицерат. Это превращение — первая реакция окисления в ходе гликолиза. Реакцию катализирует глицеральдегид-3-фосфатдегидрогеназа,которая является NAD-зависимым ферментом. Значение данной реакции заключается не только в том, что образуется восстановленный кофермент, окисление которого в дыхательной цепи сопряжено с синтезом АТФ, но также и в том, что свободная энергия окисления концентрируется в макроэргической связи продукта реакции. Глицеральдегид- 3 -фосфатдегидрогеназа содержит в активном центре остаток цистеина, сульфгидрильная группа которого принимает непосредственное участие в катализе. Окисление глицеральдегид-3-фосфата приводит к восстановлению NAD и образованию с участием Н3РО4 высокоэнергетической ангидридной связи в 1,3-бисфосфоглицерате в положении 1. В следующей реакции высокоэнергетический фосфат передаётся на АДФ с образованием АТФ. Фермент, катализирующий это превращение, назван по обратной реакции фосфоглицераткиназой (киназы называются по субстрату, находящемуся в уравнении реакции по одну сторону с АТФ).
Образование АТФ описанным способом не связано с дыхательной цепью, и его называют субстратным фосфорилированием АДФ. Образованный 3-фосфоглицерат уже не содержит макроэргической связи. В следующих реакциях происходят внутримолекулярные перестройки, смысл которых сводится к тому, что низкоэнергетический фосфоэфир переходит в соединение, содержащее высокоэнергетический фосфат. Внутримолекулярные преобразования заключаются в переносе фосфатного остатка из положения 3 в фосфоглицерате в положение 2. Затем от образовавшегося 2-фосфоглицерата отщепляется молекула воды при участии фермента енолазы. Название дегидратирующего фермента дано по обратной реакции. В результате реакции образуется замещённый енол — фосфоенолпируват. Образованный фосфоенолпируват — макроэргическое соединение, фосфатная группа которого переносится в следующей реакции на АДФ при участии пируваткиназы (фермент также назван по обратной реакции, в которой происходит фосфорилирование пирувата, хотя подобная реакция в таком виде не имеет места).
Превращение фосфоенолпирувата в пируват — необратимая реакция. Это вторая в ходе гликолиза реакция субстратного фосфорилирования. Образующаяся енольная форма пирувата затем неферментативно переходит в более термодинамически стабильную кетофор-му.
Челночные механизмы.
Глицерофосфатный челночныймеханизм основан на восстановле-нии образующегося при гликолизе фосфодигидроксиацетона (дигидрокси-ацетонфосфата) цитоплазматической глицерофосфатдегидрогеназой (1), использующей восстановленный НАДН, до α-глицерофосфата, который лег-ко проникает через обе мембраны митохондрии в матрикс и на внутренней мембране окисляется с помощью митохондриальной ФАД-зависимой гли-церофосфатдегидрогеназы (2)до дигидроксиацетонфосфата, легко перехо-дящего через мембраны митохондрии в цитозоль клетки. Образующийся ФАДН2 далее через флавинзависимый транспортирующий электроны фер-мент ЕТФ отдает свои электроны и протоны на коэнзим Q (убихинон) в ми-тохондриальную цепь транспорта электронов, где в результате использова-ния 2 моль электронов в процессе окислительного фосфорилирования гене-рируется до 1,5 моль АТФ.
Этот механизм широко используется различными тканями, особенно
печеночной и мышечной тканью, в процессе интенсивной мышечной работы.
Малат-аспартатный челночный механизмявляется более сложным,
но и более энергосберегающим. Он использует избыток восстановленного
цитоплазматического НАДН в реакции восстановления оксалоацетата (щаве-
левоуксусной кислоты) до малата (яблочной кислоты) с помощью НАД-
зависимого цитоплазматического фермента малатдегидрогеназыЯб-лочная кислота легко проникает в матрикс через обе мембраны митохондрии,
где окисляется митохондриальнойтакже НАД-зависимой, малатдегидро-
геназой(5) до оксалоацетата. Далее электроны от полученного НАДН посту-
пают в цепь транспорта электронов, где в процессе окислительного фофори-
лирования на 2 моль электронов генерируется до 2,5 моль АТФ. Образую-
щийся оксалоацетат не может покинуть митохондрию, он подвергается реак-
ции переаминирования с участием глутаминовой кислоты (глутамата) под
действием митохондриальной аспартатаминотрансферазы(3). В резуль-
тате образуется аспарагиновая кислота (аспартат), которая с помощью спе-
цифической транспортной системы переходит из митохондрии в цитоплазму,
где под действием цитоплазматической аспартатаминотрансферазы(2)
отдает свою аминогруппу α-кетоглутаровой кислоте (α-кетоглутарат), пре-
вращаясь в оксалоацетат. Следует заметить, что α-кетоглутарат и глутамат
легко проникают через внутреннюю мембрану митохондрии используя спе-
циальную ферментную транспортную систему — глутамат-α-кетоглутарат-
транслоказу(1). Внутренняя мембрана митохондрий содержит целый ряд
переносчиков для ионов и заряженных метаболитов: например, переносчик
дикарбоновых кислот опосредует облегченную обменную диффузию малата,
сукцината, фумарата и Н2РО4
–, а переносчики трикарбоновых кислот обеспе-
–. Из наиболее важных транслоказ – ферментов,
осуществляющих специфический транспорт веществ через внутреннюю
мембрану митохондрий необходимо упомянуть АТФ-АДФ-транслоказу,
осуществляющую транспорт в цитоплазму синтезирующейся в митохондриях
АТФ в обмен на поступающие в митохондрию АДФ и неорганический фос-
фат ион, вносящий в митохондрию дополнительный протон.
34. Аллостерические механизмы регуляции аэробного и анаэробного распада глюкозы.
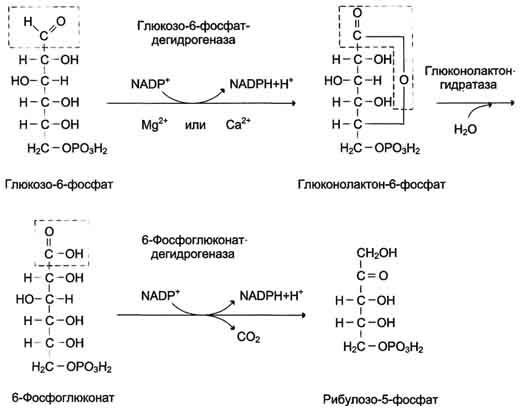
35. Пентозофосфатный путь, называемый также гексомонофосфатным шунтом, служит альтернативным путём окисления глюкозо-6-фосфата. Пентозофосфатный путь состоит из 2 фаз (частей) — окислительной и неокислительной.
В окислительной фазе глюкозо-6-фосфат необратимо окисляется в пентозу — рибулозо-5-фосфат, и образуется восстановленный NADPH.
В неокислительной фазе рибулозо-5-фосфат обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза.
Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным ко-ферментом NADPH, который используется в восстановительных процессах.
Суммарное уравнение пентозофосфатного пути выражается следующим образом:
3 Глюкозо-6-фосфат + 6 NADP + → 3 СО2 + 6 (NADPH + Н + ) + 2 Фруктозо-6-фосфат + Глицеральдегид- 3 -фосфат.
Ферменты пентозофосфатного пути, так же, как и ферменты гликолиза, локализованы в цитозоле.
Наиболее активно Пентозофосфатный путь протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе в период лактации, семенниках.
Окислительный этап
Суммарное уравнение окислительного этапапентозофосфатного пути можно представить в виде:
Глюкозо-6-фосфат + 2 NADP + + Н2О → Рибулозо-5-фосфат + 2 NADPH + Н + + СО2
Неокислительный этап
Неокислительный этап пентозофосфатного пути включает серию обратимых реакций, в результате которых рибулозо-5-фосфат превращается в рибозо-5-фосфат и ксилулозо-5-фосфат, и далее за счёт переноса углеродных фрагментов в метаболиты гликолиза — фруктозо-6-фосфат и глицеральдегид-3-фосфат. В этих превращениях принимают участие ферменты: эпимераза, изомераза, транскетолаза и трансальдолаза. Транскетолаза в качестве кофермента использует тиаминдифосфат. Неокислительный этап пентозофосфатного пути не включает реакции дегидрирования
Суммарный результатметаболизма 3 молекул рибулозо-5-фосфата в неокислительной фазе пентозофосфатного пути — образование 2 молекул фруктозо-6-фосфата и 1 молекулы глицеральдегид-3-фосфата. Далее фруктозо-6-фосфат и глицеральдегид-3-фосфат могут превратиться в глюкозу. С учётом стехиометрического коэффициента, равного 2, для образования 5 молекул глюкозы (содержащих 30 атомов углерода) потребуются 4 молекулы фруктозо-6-фосфата и 2 молекулы глицеральдегид-3-фосфата (в сумме содержащие также 30 атомов углерода) или, соответственно, 6 молекул рибулозо-5-фосфата. Таким образом, неокислительный путь можно представить как процесс возвращения пентоз в фонд гексоз.
36. Пентозофосфатный цикл
Окислительный этап образования пентоз и неокислительный этап (путь возвращения пентоз в гексозы) составляют вместе циклический процесс.
Такой процесс можно описать общим уравнением:
6 Глюкозо-6-фосфат + 12 NADP + + 2 Н2О → 5 Глюкозо-6-фосфат + 12 NADPH +12 Н + + 6 СO2.
Это означает, что из 6 молекул глюкозы образуются 6 молекул рибулозо-5-фосфат (пентозы) и 6 молекул СО2. Ферменты неокислительной
Рис. 7-63. Превращения рибулозо-5-фосфата.
Рис. 7-64. Реакция переноса двухуглеродного фрагмента, катализируемая транскетолазои.
фазы превращают 6 молекул рибулозо-5-фосфат в 5 молекул глюкозы (гексозы). При последовательном проведении этих реакций единственным полезным продуктом является NADPH, образующийся в окислительной фазе пентозофосфатного пути. Такой процесс назьюают пентозофосфатным циклом (рис. 7-67).
Протекание пентозофосфатного цикла позволяет клеткам продуцировать NADPH, необходимый для синтеза жиров, не накапливая пентозы.
Энергия, выделяющаяся при распаде глюкозы, трансформируется в энергию высокоэнергетического донора водорода — NADPH. Гидрированный NADPH служит источником водорода для восстановительных синтезов, а энергия NADPH преобразуется и сохраняется во вновь синтезированных веществах, например
Рис. 7-65. Реакция, катализируемая трансальдолазой.
Рис. 7-66. Реакция, катализируемая транскетолазой.
37.Обмен галактозы. Галактоземии.
Нарушения метаболизма галактозы
Обмен галактозы особенно интересен в связи с наследственным заболеванием — галактоземией. Галактоземиявозникает при нарушении обмена галактозы, обусловленном наследственным дефектом любого из трёх ферментов, включающих галактозу в метаболизм глюкозы
| Дефектный фермент (частота) | Блокируемая реакция | Клинические проявления и лабораторные данные |
| Галактокиназа (1:500 000) | Галактоза + АТФ → Галактозо-1-фосфат + АДФ | Галактоземия, галактозурия, катаракта. Активность фермента в эритроцитах нормальная. |
| Галактозо-1-фосфатуридилтрансфераза (1:40000) | Галактозо-1-фосфат + УДФ-глюкоза → УДФ-галактоза + Глюкозо-1-фосфат | Галактоземия, галактозурия, галактозо-1-фосфатемия, катаракта. Тенденция к гипогликемии, компенсаторная мобилизация жиров, цирроз печени, нарушения функции почек. Гепатомегалия, задержка психического развития. Активность фермента в эритроцитах снижена. |
| Уридилфосфат-4-эпимераза (1:1000000) | УДФ-глюкоза ↔ УДФ-галактоза | Галактоземия, галактозурия. Тяжёлых клинических проявлений нет. Описаны единичные случаи заболевания. |
Галактоземия, вызванная недостаточностью галактозо-1-фосфатуридилтрансферазы (ГАЛТ), наиболее хорошо изучена. Это заболевание проявляется очень рано, и особенно опасно для детей, так как основным источником углеводов для них служит материнское молоко, содержащее лактозу. Ранние симптомы дефекта ГАЛТ: рвота, диарея, дегидратация, уменьшение массы тела, желтуха. Они появляются вскоре после рождения, как только ребёнок начинает получать молоко. В крови, моче и тканях повышается концентрация галактозы и галактозо-1-фосфата. В тканях глаза (в хрусталике) галактоза восстанавливается альдоредуктазой с образованием галактитола (дульцита). В этой реакции в качестве донора водорода используется NADPH. Восстановление галактозы происходит и в ходе нормального метаболизма, но протекает с небольшой скоростью. При галактоземии галактитол накапливается в стекловидном теле и связывает большое количество воды. Вследствие этого нарушается баланс электролитов, а чрезмерная гидратация хрусталика приводит к развитию катаракты, которая наблюдается уже через несколько дней после рождения.
Тяжёлые последствия дефекта ГАЛТ наблюдают в печени. Это связано с накоплением галактозо-1-фосфата и его токсическим действием на гепатоциты. В результате возникают нарушения функции печени: гепатомегалия, жировая дистрофия. В почках таких больных также повышена концентрация галактитола и галактозо-1-фосфата, что влияет на их функции. Отмечают нарушения в клетках полушарий головного мозга и мозжечка, в тяжёлых случаях — отёк мозга, задержку умственного развития, возможен летальный исход. Для галактоземии, вызванной дефектом галактокиназы, тоже характерна катаракта, но при этом заболевании, в отличие от дефекта ГАЛТ, не отмечают нарушений функций печени, почек, мозга. Наиболее тяжёлые последствия снижения активности ГАЛТ связывают с влиянием галактозо-1-фосфата на активность других ферментов, участвующих в углеводном обмене (фосфоглюкомутазы, глюкозо-6-фосфатдегидрогеназы). Известно несколько форм галактоземии, причиной которой является недостаточность ГАЛТ Некоторые дефекты в строении ГАЛТ приводят лишь к частичной потере активности фермента. Поскольку в норме ГАЛТ присутствует в организме в избытке, то снижение его активности до 50%, а иногда и ниже может клинически не проявляться. При диагностике галактоземии исследуют мочу на содержание галактозы, собранную после нескольких кормлений молоком. При обнаружении у ребёнка катаракты его обследуют на недостаточность галактокиназы и ГАЛТ. Наличие галактозы в моче при отсутствии нарушений функции печени указывает на дефект галактокиназы. При обследовании проведение теста с нагрузкой галактозой не рекомендуется, так как этот тест опасен для больных. Лечение заключается в удалении галактозы из рациона.
38. Обмен дисахаридов в норме. Нарушения.
39. Обмен фруктозы.
Нарушения метаболизма фруктозы
| Неактивный фермент | Блокируемая реакция | Локализация фермента | Клинические проявления и лабораторные данные |
| Фруктокиназа | Фруктоза + АТФ → Фруктозе-1-фосфат + АДФ | Печень Почки Энтероциты | Фруктоземия, фруктозурия |
| Фруктозе-1-фосфатальдолаза | Фруктозе-1-фосфат → Дигидроксиацетон-3 -фосфат + Глицеральдегид | Печень | Рвота, боли в животе, диарея, гипогликемия, Гипофосфатемия, фруктоземия, гиперурикемия, хроническая недостаточность функций печени, почек. |
Недостаточность фруктокиназы клинически не проявляется. Фруктоза накапливается в крови и выделяется с мочой, где её можно обнаружить лабораторными методами. Очень важно не перепутать эту безвредную аномалию с сахарным диабетом. Данное заболевание известно как доброкачественная эссенциальная фруктозурия и встречается с частотой 1:130 000.
Наследственная непереносимость фруктозы,возникающая при генетически обусловленном дефекте фруктозо-1-фосфатальдолазы, не проявляется, пока ребёнок питается грудным молоком, т.е. пока пища не содержит фруктозы. Симптомы возникают, когда в рацион добавляют фрукты, соки, сахарозу. Рвота, боли в животе, диарея, гипогликемия и даже кома и судороги возникают через 30 мин после приёма пищи, содержащей фруктозу. У маленьких детей и подростков, продолжающих принимать фруктозу, развиваются хронические нарушения функций печени и почек. Непереносимость фруктозы — достаточно частая аутосомно-рецессивная форма патологии.


 |
|
40. Свойства и распространение гликогена как резервного полисахарида.
Гликоген — разветвлённый гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы. Следовательно, точки ветвления в гликогене встречаются примерно через каждые десять остатков глюкозы. Так возникает древообразная структура с молекулярной массой >10 7 Д, что соответствует приблизительно 50 000 остатков глюкозы. Таким образом, в молекуле гликогена имеется только одна свободная аномерная ОН-группа и, следовательно, только один восстанавливающий (редуцирующий) конец. В клетках животных гликоген — основной резервный полисахарид. При полимеризации глюкозы снижается растворимость образующейся молекулы гликогена и, следовательно, её влияние на осмотическое давление в клетке. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза. Гликоген хранится в цитозоле клетки в форме гранул диаметром 10-40 нм. С гранулами связаны и некоторые ферменты, участвующие в метаболизме гликогена, что облегчает их взаимодействие с субстратом. Разветвлённая структура гликогена обусловливает большое количество концевых мономеров, что способствует работе ферментов, отщепляющих или присоединяющих мономеры при распаде или синтезе гликогена, так как эти ферменты могут одновременно работать на нескольких ветвях молекулы. Гликоген депонируется главным образом в печени и скелетных мышцах. Распад гликогена печени служит в основном для поддержания уровня глюкозы в крови в постабсорбтивном периоде. Поэтому содержание гликогена в печени изменяется в зависимости от ритма питания. При длительном голодании оно снижается почти до нуля. Гликоген мышц служит резервом глюкозы — источника энергии при мышечном сокращении. Мышечный гликоген не используется для поддержания уровня глюкозы в крови. Как уже упоминалось ранее, в клетках мышц нет фермента глюкозо-6-фосфатазы, и образование свободной глюкозы невозможно. Расход гликогена в мышцах зависит в основном от физической нагрузки.
41. Синтез гликогена в печени и мышцах.
Гликоген синтезируется в период пищеварения (через 1-2 ч после приёма углеводной пищи). Следует отметить, что синтез гликогена из глюкозы как и любой анаболический процесс, является эндергоническим, т.е. требующим затрат энергии. Глюкоза, поступающая в клетку, фосфорилируется при участии АТФ (реакция 1). Затем глюкозо-6-фосфат в ходе обратимой реакции превращается в глюкозо-1 -фосфат (реакция 2) под действием фермента фосфоглюкомутазы. Глюкозо-1-фосфат по термодинамическому состоянию мог бы служить субстратом для синтеза гликогена. Но в силу обратимости реакции глюкозо-6-фосфат ↔ глюкозо-1-фосфат синтез гликогена из глюкозо-1-фосфата и его распад оказались бы также обратимыми и поэтому неконтролируемыми. Чтобы синтез гликогена был термодинамически необратимым, необходима дополнительная стадия образования уридинди-фосфатглюкозы из УТФ и глюкозо-1-фосфа
Последнее изменение этой страницы: 2017-01-24; Нарушение авторского права страницы
источник




