Резервы гликогена используются по-разному в зависимости от функциональных особенностей клетки.
Гликоген печени расщепляется при снижении концентрации глюкозы в крови, прежде всего между приемами пищи. Через 12-18 часов голодания запасы гликогена в печени полностью истощаются.
В мышцах количество гликогена снижается обычно только во время физической нагрузки – длительной и/или напряженной. Гликоген здесь используется для обеспечения глюкозой работы самих миоцитов. Таким образом, мышцы, как впрочем и остальные органы, используют гликоген только для собственных нужд.
Мобилизация (распад) гликогена или гликогенолиз активируется при недостатке свободной глюкозы в клетке, а значит и в крови (голодание, мышечная работа). При этом уровень глюкозы крови «целенаправленно» поддерживает только печень, в которой имеется глюкозо-6-фосфатаза, гидролизующая фосфатный эфир глюкозы. Образуемая в гепатоците свободная глюкоза выходит через плазматическую мембрану в кровь.
В гликогенолизе непосредственно участвуют три фермента:
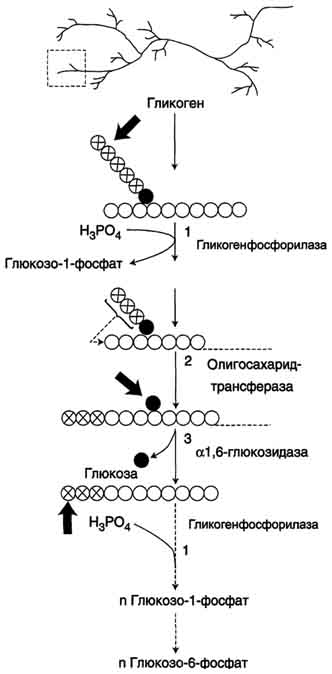
1. Фосфорилаза гликогена (кофермент пиридоксальфосфат) – расщепляет α-1,4-гликозидные связи с образованием глюкозо-1-фосфата. Фермент работает до тех пор, пока до точки ветвления (α1,6-связи) не останется 4 остатка глюкозы.
2. α(1,4)-α(1,4)-Глюкантрансфераза – фермент, переносящий фрагмент из трех остатков глюкозы на другую цепь с образованием новой α1,4-гликозидной связи. При этом на прежнем месте остается один остаток глюкозы и «открытая» доступная α1,6-гликозидная связь.
3. Амило-α1,6-глюкозидаза, («деветвящий» фермент) – гидролизует α1,6-гликозидную связь с высвобождением свободной (нефосфорилированной) глюкозы. В результате образуется цепь без ветвлений, вновь служащая субстратом для фосфорилазы.
Гликоген способен синтезироваться почти во всех тканях, но наибольшие запасы гликогена находятся в печени и скелетных мышцах.
В мышцах количество гликогена снижается обычно только во время физической нагрузки – длительной и/или напряженной. Накопление гликогена здесь отмечается в период восстановления, особенно при приеме богатой углеводами пищи.
Гликоген печени расщепляется при снижении концентрации глюкозы в крови, прежде всего между приемами пищи (постабсорбтивный период). Через 12-18 часов голодания запасы гликогена в печени полностью истощаются. Накапливается гликоген в печени только после еды, при гипергликемии. Это объясняется особенностями печеночной гексокиназы ( глюкокиназы ), которая имеет низкое сродство к глюкозе и может работать только при ее высоких концентрациях.
При нормальных концентрациях глюкозы в крови ее захват печенью не производится.
Непосредственно синтез гликогена осуществляют следующие ферменты:
1. Фосфоглюкомутаза – превращает глюкозо-6-фосфат в глюкозо-1-фосфат;
2. Глюкозо-1-фосфат-уридилтрансфераза – фермент, осуществляющий ключевую реакцию синтеза. Необратимость этой реакции обеспечивается гидролизом образующегося дифосфата;
3. Гликогенсинтаза – образует α1,4-гликозидные связи и удлиняет гликогеновую цепочку, присоединяя активированный С 1 УДФ-глюкозы к С 4 концевого остатка гликогена;
4. Амило-α1,4-α1,6-гликозилтрансфераза,»гликоген-ветвящий» фермент – переносит фрагмент с минимальной длиной в 6 остатков глюкозы на соседнюю цепь с образованием α1,6-гликозидной связи.
источник
БИОСИНТЕЗ И РАСПАД ГЛИКОГЕНА В ТКАНЯХ.
Было установлено, что гликоген может синтезироваться практически во всех органах и тканях. Однако наибольшая его концентрация обнаружена в печени (2-6%) и мышцах (0,5-2%). Поскольку мышечная масса организма человека велика, то большая часть гликогена организма содержится в мышцах. Глюкоза из крови легко проникает в клетки органов и тканей, проходя через биологические мембраны клеток. Как только глюкоза поступает в клетку, она метаболизируется в ней в результате первой химической реакции. фосфорилирование глюкозы происходит в присутствии АТФ и фермента — гексокиназы. Глюкоза превращается в глюкозо-6-фосфат . Этот эфир глюкозы теперь будет использоваться в анаболических и катаболических реакциях. Глюкоза из клетки может выйти только после реакции гидролиза при участии глюкозо-6-фосфатазы. Этот фермент есть в печени, почках, эпителии кишечника. В других органах, тканях его нет. Процесс биосинтеза гликогена протекает в 4 стадии:
Гликогенсинтаза – является трансферазой, которая переносит остатки глюкозы, входящие в УДФ- глюкозу, на гликозидную связь остаточного в клетке гликогена, при этом образуется альфа(1,4)-гликозидные связи.
Образование альфа(1,6)-гликозидных связей в точках ветвления гликогена катализирует специальный гликоген-ветвящий фермент.
Образовавшийся в последней реакции УДФ, превращается в УТФ, при этом при биосинтезе гликогена поглощается еще 1 молекула АТФ.
Таким образом, на каждую молекулу глюкозы, включающуюся в структуру гликогена, расходуется 2 молекулы АТФ.
Гликоген в клетках накапливается во время пищеварения и рассматривается как резервная форма глюкозы, которая используется клетками в промежутках между приёмами пищи.
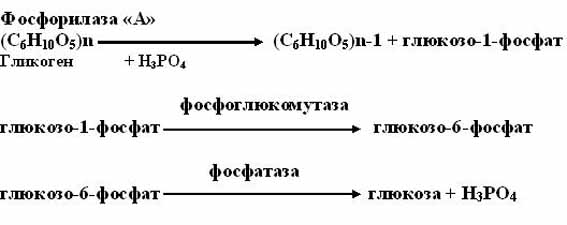
Существуют 2 пути распада гликогена в тканях:
1. фосфоролитический путь (основной путь)
Протекает в печени, почках, эпителии кишечника. Схематически его можно записать в виде 3 реакций:
2. амилолитический путь (неосновной).
Протекает в печени при участии 3 ферментов: альфа -амилазы, амило-1,6-гликозидазы, гамма — амилазы.
Альфа – амилаза расщепляет в структуре крахмала альфа-1,4-гликозидные связи, амило-1,6-гликозидаза-гликозидные связи в точках ветвления, гамма-амилаза гидролизует концевые гликозидные связи в боковых ветвях гликогена.
ГЛИКОГЕНОЗЫ — болезни, связанные с нарушением процессов распада гликогена, при этом в клетках печени, почек, мышц гликоген накапливается в большом количестве. Клинически эти заболевания проявляются увеличением печени, мышечной слабостью, гипоглюкоземией натощак. Больные умирают в раннем детском возрасте. Наиболее часто встречаются следующие заболевания:
1.Болезнь Герса (генетический дефект фермента — фосфорилазы печени ).
2. Болезнь Мак-Ардля (генетический дефект фермента — фосфорилазы мышц ).
3. Болезнь Помпе (генетический дефект фермента — амило- 1,4-гликозидазы ).
4. Болезнь Кори (генетический дефект фермента — амило-1.6-гликозидазы ).
5. Болезнь Гирке (генетический дефект фермента — глюкозо-
АГЛИКОГЕНОЗЫ- болезни связанные с нарушением процессов синтеза гликогена в тканях. Характерными проявлениями нарушения синтеза гликогена являются: резкая гипогликемия натощак, рвоты, судороги, потеря сознания. Углеводное голодание клеток мозга приводит к нарушению психо-физического развития у детей. Смерть наступает в раннем детском возрасте. Наиболее часто встречаются:
1. Болезнь Льюиса (генетический дефект фермента – гликогенсинтазы ).
2. Болезнь Андерсена ( генетический дефект фермента — гликоген-ветвящего ).
| Раздел верхнего уровня | Следующий раздел |
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студентов недели бывают четные, нечетные и зачетные. 9155 — 

95.83.2.240 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Расщепление и синтез гликогена осуществляют различные ферменты.
Расщепление гликогена с образованием глюкозо-1-фосфата катализирует гликоген-фосфорилаза (рис. 5). А синтез гликогена происходит при участии других ферментов.
Основные этапы синтеза гликогена следующие.
1. На первом этапе из свободной глюкозы образуется глюкозо-6-фосфат:
АТФ + Глюкоза > Глюкозо-6-фосфат + АДФ
2. Затем из глюкозо-6-фосфата образуется глюкозо-1-фосфат. Эта реакция обратима.
3. Следующий этап является ключевым. В реакции катализируемой глюкозо-1-фосфат-уридилтрансферазой образуется уридилдифосфатглюкоза (UDP-глюкоза):
UТP + Глюкозо-1-фосфат > UDP-глюкоза + РРi.
4. Далее гликоген-синтаза катализирует перенос гликозильных групп от UDP-глюкозы на молекулу гликогена с образованием альфа(1-4)-связи.
5. Образование боковой цепи гликогена катализирует «ветвящий» фермент гликозил-(4-6)-трансфераза.
В организме человека, как и животных, гликоген синтезируется практически во всех тканях, но больше всего в печени и скелетных мышцах.
Регуляция расщепления и синтеза гликогена также взаимосвязана
Также как гликолиз и глюконеогенез, расщепление и синтез гликогена регулируются взаимосвязано.
Если гликоген-фосфорилаза активируется, то гликоген-синтаза ингибируется, и наоборот.
Регуляцию этих ферментов в печени в конечном счете осуществляют гормоны: инсулин и контринсулярные гормоны, например, адреналин и глюкагон. Инсулин ингибирует распад и стимулирует синтез гликогена.
Контринсулярные гормоны стимулируют расщепление гликогена. Некоторые контринсулярные гормоны проявляют селективность по отношению к различным органам и тканям. Например, глюкагон стимулирует расщепление гликогена только в печени, но не в скелетных мышцах.
Гликогенозы. Ряд наследственных болезней связан с нарушением обмена гликогена. Эти болезни получили название гликогенозов. Они возникают в связи с дефицитом или полным отсутствием ферментов, катализирующих процессы распада или синтеза гликогена, и характеризуются избыточным его накоплением в различных органах и тканях (табл. 10.2).
Гликогеноз I типа (болезнь Гирке) встречается наиболее часто, обусловлен наследственным дефектом синтеза фермента глюкозо-6-фосфатазы впечени и почках. Болезнь наследуется по аутосомно-рецессивному типу. Патологические симптомы появляются уже на первом году жизни ребенка: увеличена печень, нередко увеличены почки. В результате гипогликемии появляются судороги, задержка роста, возможен ацидоз. В крови – повышенное количество лактата и пирувата. Введение адреналина или глюка-гона вызывает значительную гиперлактатацидемию, но негипергликемию, так как глюкозо-6-фосфатаза в печени отсутствует и образования свободной глюкозы не происходит.
57. Регуляция обмена углеводов и поддержания физиологического уровня глюкозы в крови. Характеристика гормонов и механизм их действия. Гипо- и гипергликемии.
. Гормоны. К гормонам, которые влияют на углеводный обмен, принадлежат пептиды инсулин иглюкагон, глюкокортикоид кортизол и катехоламин адреналин (см. сс. 362, 368). Инсулининдуцирует (см. с. 120) синтез de novo гликоген-синтазы [1], а также некоторых ферментов гликолиза [3, 5, 7]. Одновременно инсулин подавляет синтез ключевых ферментов глюконеогенеза (репрессия,[4, 6, 8, 9]). Глюкагон как антагонист инсулина действует в противоположном направлении: индуцирует ферменты глюконеогенеза [4, 6, 8, 9] и репрессирует пируваткиназу [7], ключевой фермент гликолиза. Другие аффекты глюкагона основаны на взаимопревращении ферментов и опосредованы вторичным мессенджером цАМФ (сАМР, см. с. 114). По этому механизму тормозится синтез гликогена [1] и активируется расщепление гликогена [2]. Подобным образом действует и адреналин. Торможение пируваткиназы [7] глюкагоном также обусловлено взаимопревращением ферментов.
Глюкокортикоиды, прежде всего кортизол (см. с. 362), индуцируют все ключевые ферменты глюконеогенеза [4, 6, 8, 9]. Одновременно они индуцируют ферменты деградации аминокислот и обеспечивают тем самым глюконеогенез исходными соединениями.
Метаболиты. Высокие концентрации АТФ (АТР) и цитрата тормозят гликолиз путем аллостерической регуляции фосфофруктокиназы. Кроме того, АТФ тормозит пируваткиназу. Ингибитором пируваткиназы является ацетил-КоА. Все эти метаболиты образуются при распаде глюкозы (торможение конечным продуктом). АМФ (AMP), сигнал дефицита АТФ, активирует расщепление гликогена и тормозит глюконеогенез.
Гипогликемия. Нередко гипогликемия связана с понижением функций тех эндокринных желез, повышение функций которых приводит, как отмечалось, к гипергликемии. В частности, гипогликемию можно наблюдать при гипофизарной кахексии, аддисоновой болезни, гипотиреозе. Резкое снижение уровня глюкозы в крови отмечается при аденомах поджелудочной железы вследствие повышенной продукции инсулина β-клетками панкреатических островков. Кроме того, гипогликемия может быть вызвана голоданием, продолжительной физической работой, приемом β-ганглиоблока-торов. Низкий уровень глюкозы в крови иногда отмечается при беременности, лактации.
Гипогликемия может возникнуть при введении больным сахарным диабетом больших доз инсулина. Как правило, она сопровождает почечную глюкозурию, возникающую вследствие снижения «почечного порога» для глюкозы.
58. Особенности обмена глюкозы в различных тканях (мышцы, эритроциты, мозг, жировая ткань, печень). Зависимость путей использования глюкоза от ритма и характера питания.
ОСОБЕННОСТИ И ЗНАЧЕНИЕ ГЛИКОЛИЗА В ЭРИТРОЦИТАХ 1. Генерация АТФ. АТФ используется для 1) активного транспорта катионов через мембрану, 2) сохранения целостности мембраны и формы эритроцитов. 2. В процессе гликолиза генерируется НАДН2, который является: 1) кофактором метгемоглобинредуктазы — фермента, катализирующего переход мет-Hb в Hb; этот процесс предотвращает накопление мет-Hb (кофактором может являться и НАДФН2); 2) кофактором ЛДГ (лактатдегидрогеназы); 3) поставщиком протонов для супероксиддисмутазной реакции. 3. В процессе гликолиза 1,3-дифосфоглицерат (1,3-ДФГ) превращается в 2,3-ДФГ. На этот процесс расходуется 20-25% глюкозы. 2,3-ДФГ — активная отрицательно заряженная молекула. В эритроцитах периферической крови образует солевую связь с Hb, уменьшает его сродство к кислороду, что обеспечивает переход кислорода в клетки тканей. В капиллярах легких Hb освобождается от 2,3-ДФГ и приобретает способность акцептировать кислород. ПФП — ГЛАВНОЕ НАЗНАЧЕНИЕ — генерация восстановленного кофактора НАДФН2, который используется в эритроцитах для восстановления глутатиона при участии глутатионредуктазы, поставляет протоны для супероксидодисмутазной реакции, хотя и слабо, но используется мет-Hb-редуктазой для восстановления мет-Hb в Hb. Промежуточный продукт ПФП — 3-ФГА (3-фосфоглицериновый альдегид) используется в процессе гликолиза, в том числе и для синтеза 2,3-ДФГ.
Глюкоза высвобождается из печени в промежутках между приемами пищи. Если уровень глюкозы в крови начинает снижаться до нижнего предела в промежутках между приемами пищи, это приведен к ряду изменений и послужит поводом для высвобождения глюкозы из печени в кровоток. 1. Снижение уровня глюкозы приводит к снижению секреции инсулина поджелудочной железой.
2. Отсутствие инсулина приведет к изменению направления реакций, нацеленных на создание запаса гликогена, главным образом к остановке дальнейшего синтеза гликогена в печени и предупреждению поступления глюкозы в печень из крови.
3. Отсутствие инсулина (параллельно с увеличением глюкагона, что будет рассмотрено далее) активирует фермент фосфорилазу, расщепляющую гликоген до глюкозофосфата.
4. Фермент глюкофосфатаза, ингибируемый инсулином, при отсутствии инсулина активируется и приводит к отщеплению фосфатного радикала от глюкозы, что позволяет свободной глюкозе вернуться в кровь.
Таким образом, печень забирает глюкозу из крови, когда в крови возникает ее избыток в связи с приемом пищи, и возвращает ее в кровь, когда концентрация глюкозы снижается в промежутках между приемами пищи. Обычно около 60% глюкозы пищи запасается таким способом в печени и в последующем возвращается в кровь. Инсулин обеспечивает превращение избытка глюкозы в жирные кислоты и ингибирует глюконеогенез в печени.
Цель мышечной клетки – наиболее эффективно использовать поступающую глюкозу для образования АТФ, необходимого для осуществления механической работы – сокращения. В состоянии покоя значительные количества глюкозы резервируются в форме гликогена. Цитоплазма мышечных клеток содержит в высоких концентрациях ферменты гликолиза, а изобилие митохондрий обеспечивает эффективный распад продуктов гликолиза через путь лимонной кислоты и цепь переноса электронов. Лишь в условиях крайнего утомления эти аэробные процессы е справляются с накоплением лактата.
В мышцах идет гликогенез, мышца осуществляет лишь немногие синтетические функции. Ключевые ферменты глюконеогенеза в мышцах отсутствуют, и глюконеогенез не идет. Для востановительных синтезов в мышце НАДФ . Н не требуется, и фосфоглюконатный путь почти не функционирует.
Обмен углеводов в мышцах обеспечивает создание тканевых запасов гликогена в состоянии покоя и использование этих запасов, а также поступающей глюкозы при напряженной работе; основные энергетические потребности всех типов мышц удовлетворяются главным образом за счет окисления продуктов обмена жиров. Ни медленно сокращающаяся гладкая мышечная ткань, ни сердечная мышца не потребляют глюкозу в значительной мере. Во время напряженной работы сердце обеспечивает себя лактатом для окисления.
источник
БИОСИНТЕЗ И РАСПАД ГЛИКОГЕНА В ТКАНЯХ.
Было установлено, что гликоген может синтезироваться практически во всех органах и тканях. Однако наибольшая его концентрация обнаружена в печени (2-6%) и мышцах (0,5-2%). Поскольку мышечная масса организма человека велика, то большая часть гликогена организма содержится в мышцах. Глюкоза из крови легко проникает в клетки органов и тканей, проходя через биологические мембраны клеток. Как только глюкоза поступает в клетку, она метаболизируется в ней в результате первой химической реакции. фосфорилирование глюкозы происходит в присутствии АТФ и фермента — гексокиназы. Глюкоза превращается в глюкозо-6-фосфат . Этот эфир глюкозы теперь будет использоваться в анаболических и катаболических реакциях. Глюкоза из клетки может выйти только после реакции гидролиза при участии глюкозо-6-фосфатазы. Этот фермент есть в печени, почках, эпителии кишечника. В других органах, тканях его нет. Процесс биосинтеза гликогена протекает в 4 стадии:
Гликогенсинтаза – является трансферазой, которая переносит остатки глюкозы, входящие в УДФ- глюкозу, на гликозидную связь остаточного в клетке гликогена, при этом образуется альфа(1,4)-гликозидные связи.
Образование альфа(1,6)-гликозидных связей в точках ветвления гликогена катализирует специальный гликоген-ветвящий фермент.
Образовавшийся в последней реакции УДФ, превращается в УТФ, при этом при биосинтезе гликогена поглощается еще 1 молекула АТФ.
Таким образом, на каждую молекулу глюкозы, включающуюся в структуру гликогена, расходуется 2 молекулы АТФ.
Гликоген в клетках накапливается во время пищеварения и рассматривается как резервная форма глюкозы, которая используется клетками в промежутках между приёмами пищи.
Существуют 2 пути распада гликогена в тканях:
1. фосфоролитический путь (основной путь)
Протекает в печени, почках, эпителии кишечника. Схематически его можно записать в виде 3 реакций:
2. амилолитический путь (неосновной).
Протекает в печени при участии 3 ферментов: альфа -амилазы, амило-1,6-гликозидазы, гамма — амилазы.
Альфа – амилаза расщепляет в структуре крахмала альфа-1,4-гликозидные связи, амило-1,6-гликозидаза-гликозидные связи в точках ветвления, гамма-амилаза гидролизует концевые гликозидные связи в боковых ветвях гликогена.
ГЛИКОГЕНОЗЫ — болезни, связанные с нарушением процессов распада гликогена, при этом в клетках печени, почек, мышц гликоген накапливается в большом количестве. Клинически эти заболевания проявляются увеличением печени, мышечной слабостью, гипоглюкоземией натощак. Больные умирают в раннем детском возрасте. Наиболее часто встречаются следующие заболевания:
1.Болезнь Герса (генетический дефект фермента — фосфорилазы печени ).
2. Болезнь Мак-Ардля (генетический дефект фермента — фосфорилазы мышц ).
3. Болезнь Помпе (генетический дефект фермента — амило- 1,4-гликозидазы ).
4. Болезнь Кори (генетический дефект фермента — амило-1.6-гликозидазы ).
5. Болезнь Гирке (генетический дефект фермента — глюкозо-
АГЛИКОГЕНОЗЫ- болезни связанные с нарушением процессов синтеза гликогена в тканях. Характерными проявлениями нарушения синтеза гликогена являются: резкая гипогликемия натощак, рвоты, судороги, потеря сознания. Углеводное голодание клеток мозга приводит к нарушению психо-физического развития у детей. Смерть наступает в раннем детском возрасте. Наиболее часто встречаются:
1. Болезнь Льюиса (генетический дефект фермента – гликогенсинтазы ).
2. Болезнь Андерсена ( генетический дефект фермента — гликоген-ветвящего ).
источник
| Гликоген в клетках накапливается во время пищеварения и рассматривается как резервная форма глюкозы, которая используется клетками в промежутках между приёмами пищи. |
Было установлено, что гликоген может синтезироваться практически во всех органах и тканях. Однако наибольшая его концентрация обнаружена в печени (2-6%) и мышцах (0,5-2%). Поскольку мышечная масса организма человека велика, то большая часть гликогена организма содержится в мышцах. Глюкоза из крови проникает в клетки органов и тканей, проходя через биологические мембраны клеток. Как только глюкоза поступает в клетку, она метаболизируется в ней в результате первой химической реакции. Фосфорилирование глюкозы происходит в присутствии АТФ и фермента — гексокиназы. Глюкоза превращается в глюкозо-6-фосфат. Этот эфир глюкозы теперь будет использоваться в анаболических и катаболических реакциях.
| Гликогенсинтаза катализирует образование α-1,4-гликозидных связей. В местах ветвления связь α-1,6-гликозидная. В её образовании принимает участие гликогенветвящий фермент. Ветвление происходит приблизительно у каждого 10 остатка глюкозы. |
| Синтез гликогена: |
| (С6Н12О5)n+1Гликоген — УДФ |
| +(С6Н12О5)n Гликоген — УДФ — УДФ |
| Гликогенсинтаза |
| Уридилтрансфераза |
| УДФ-глюкоза |
| + УТФ — ФФН |
Распад гликогена.Существуют 2 пути распада гликогена в тканях:1.) Фосфоролитический путь (основной путь). Протекает в печени, почках, эпителии кишечника.2.) Амилолитический путь (неосновной).Происходит в печени при участии 3 ферментов: альфа-амилазы, амило-1,6-гликозидазы, гамма-амилазы.
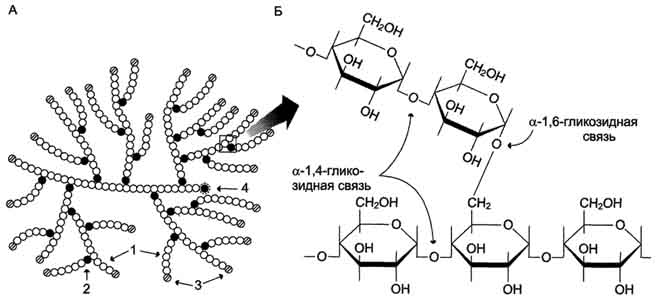
| Распад гликогена. В рамке — фрагмент гликогена с точкой ветвления. Закрашенный кружок — глюкозный остаток, связанный α-1,6-гликозидной связью. Светлые и заштрихованные кружки — глюкозные остатки в линейных участках и боковых ветвях, связанные α-1,4-гликозидной связью. 1 — гликогенфосфорилаза; 2 — олигосахаридтрансфераза; 3 — α-1,6-глюкозидаза. |
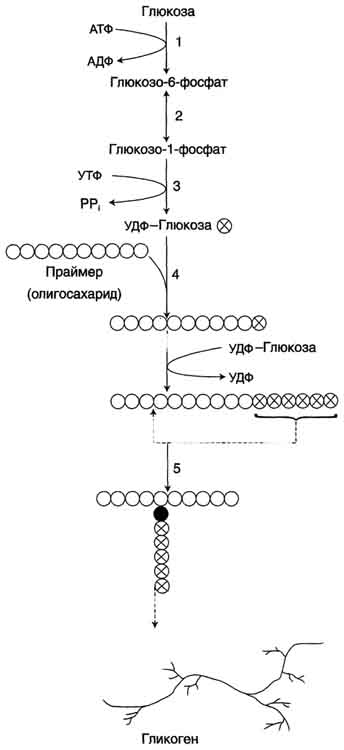
| Синтез гликогена. 1 — глюкокиназа или гексокиназа; 2 — фосфоглюкомутаза; 3 – УДФ-глюкрпирофосфорилаза; 4 — гликогенсинтаза (глюкозилтрансфераза); 5 — фермент «ветвления» (амило-1,4 → 1,6-глюкозилтрансфераза), светлые и заштрихованные кружки — глюкозные остатки, закрашенные кружки — глюкозные остатки в точке ветвления. |
Сравнение процессов распада и синтеза гликогена позволяет сделать следующие выводы:— синтез и распад гликогена протекают по разным метаболическими путям;- печень запасает глюкозу в виде гликогена не столько для собственных нужд, сколько для поддержания постоянной концентрации глюкозы в крови, и, следовательно, обеспечивает поступление глюкозы в другие ткани. Присутствие в печени глюкозо-6-фосфатазы обусловливает эту главную функцию печени в обмене гликогена;- функция мышечного гликогена заключается в освобождении глюкозо-6-фосфата, потребляемого в самой мышце для окисления и использования энергии;- синтез гликогена — процесс эндергонический. Так на включение одного остатка глюкозы в полисахаридную цепь используется 1 моль АТФ и 1 моль УТФ;- распад гликогена до глюкозо-6-фосфата не требует энергии;- необратимость процессов синтеза и распада гликогена обеспечивается их регуляцией.
| Структура гликогена. А.Строение молекулы гликогена: 1 — остатки глюкозы, соединённые α-1,4-гликозидной связью; 2 — остатки глюкозы, соединённые α-1,6-гликозидной связью; 3 — нередуцирующие концевые мономеры; 4 — редуцирующий концевой мономер. Б. Строение отдельного фрагмента молекулы гликогена. |
38. Глюконеогенез. Возможные предшественники, последовательность реакций, биологическая роль. Химизм образования глюкозы из лактата.
Основными источниками глюкозы для организма человека являются:1.) Углеводы пищи; 2.) Гликоген тканей; 3.) Глюконеогенез. Глюконеогенез — это биосинтез глюкозы из неуглеводных предшественников, главными из которых являются пируват, лактат, глицерин, метаболиты ЦТК, аминокислоты. Глюконеогенез возможен не во всех тканях. Главным местом синтеза глюкозы является печень, в меньшей степени процесс идёт в почках и слизистой кишечника.
В клетках организма всегда есть потребность в глюкозе: 1.) Для эритроцитов – единственный источник энергии. 2.) Нервная ткань потребляет примерно 120г глюкозы в сутки. 3.) Поддержка метаболизма.
Значение глюконеогенеза:• Важнейший источник глюкозы при низком содержании углеводов в пище, голодании, длительной физической работе. • Утилизация лактата, постоянно образуемого в эритроцитах или при мышечной работе, и глицерола, являющегося продуктом липолиза в жировой ткани.
Ключевые ферменты глюконеогенеза:• Пируваткарбоксилаза; • Фосфоенолпируваткарбоксикиназа; • Фруктозо-1,6-дифосфатаза; • Глюкозо-6-фосфатаза.
Лактат, образовавшийся в интенсивно работающих мышцах (особенно в белых мышечных волокнах, которые бедны митохондриями по сравнению с красными) или в клетках с преобладающим анаэробным путем катаболизма глюкозы, поступает в кровь, а затем в печень. В печени отношение NADH/NAD + ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в обратном направлении, т.е. в сторону образования пирувата из лактата. Далее пируват включается в глюконеогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами.
Большинство реакций глюконеогенеза представляют собой обратные реакции гликолиза, за исключением трёх термодинамически необратимых: ПИРУВАТКИНАЗНОЙ, ФОСФОФРУКТОКИНАЗНОЙ, ГЕКСОКИНАЗНОЙ. Эти реакции при глюконеогенезе имеют обходные пути и связаны с образованием 2-фосфоенолпирувата, фруктозо-6-фосфата и глюкозы.
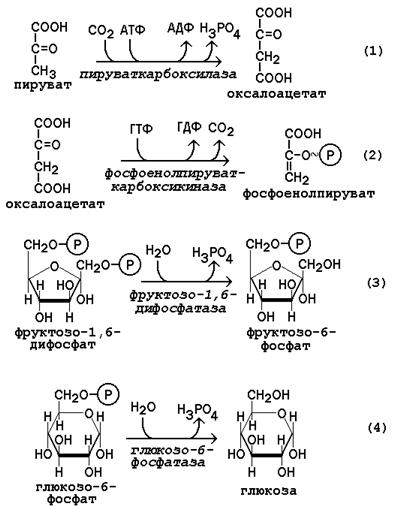
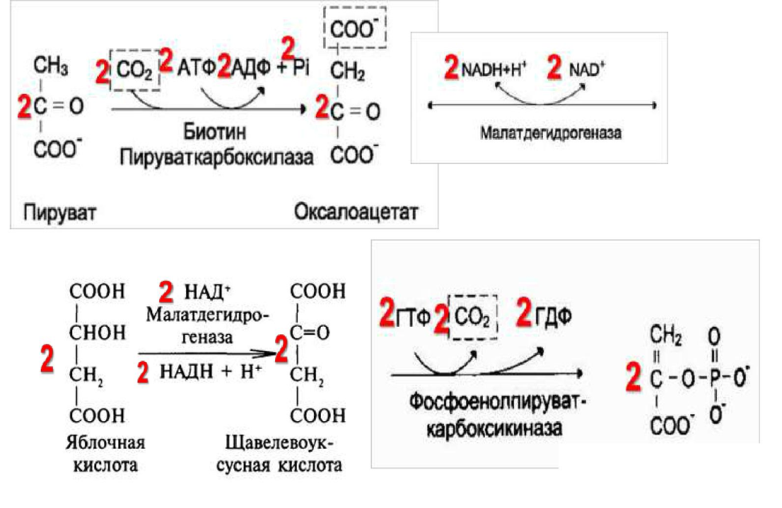
1.) Обходной путь пируваткиназной реакции. Превращение пирувата в фосфоенолпируват. Первоначально пируват под влиянием пируваткарбоксилазы и при участии СО2 и АТФкарбоксилируется с образованием оксалоацетата: СН3-С(=О)-СООН + СО2 + АТФ НООС-СН2-С(=О)-СООН + АДФ + ФН. Затем оксалоацетат в результате декарбоксилирования и фосфорилирования под влиянием фермента фосфоенолпируваткарбоксилазы превращается в фосфоенолпируват. Реакция обратима. Донором фосфатного остатка в реакции служит гуанозинтрифосфат (ГТФ): НООС-СН2-С(=О)-СООН + ГТФ СН2=С(О
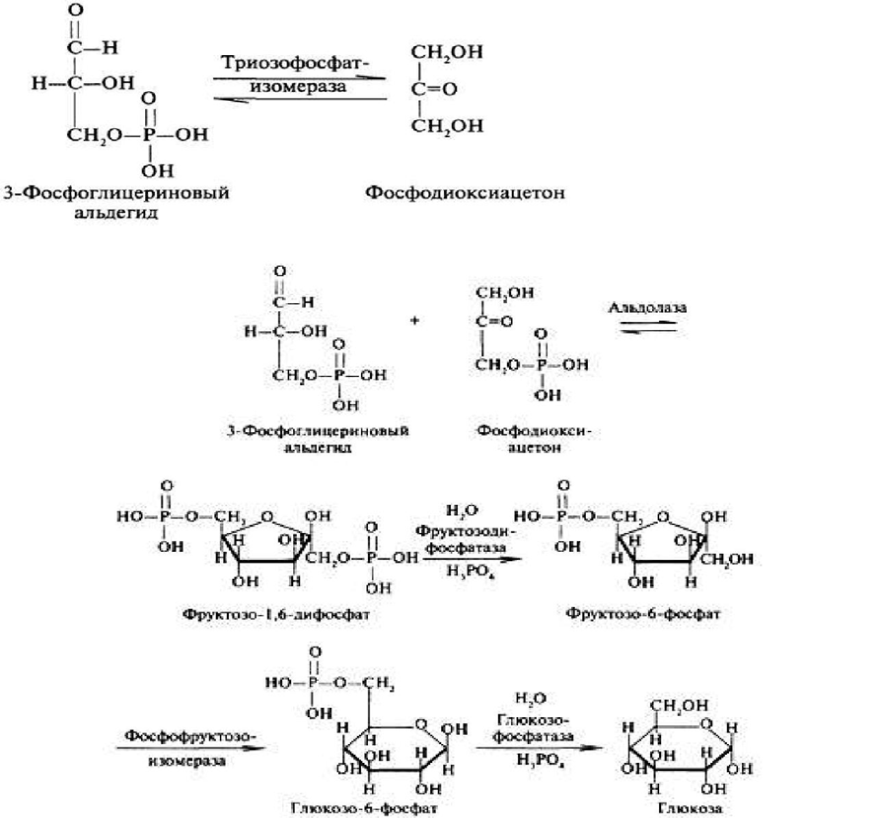
2.) Обходной путь фосфофруктокиназной реакции. Превращение фруктозо-1,6-бифосфата во фруктозо-6-фосфат. Фосфоенолпируват, образовавшийся из пирувата, в результате ряда обратимых реакций глюконеогенеза превращается во фруктозо-1,6-бифосфат. Далее следует фосфофруктокиназная реакция, которая необратима. Глюконеогенез идёт в обход этой эндергонической реакции. Превращение фруктозо-1,6-бифосфата во фруктозо-6-фосфат катализируется специальной фосфатазой – фруктозобифосфатазой.
| Обходные реакции глюконеогенеза: |
| Образование глюкозы из пирувата: |
3.) Обходной путь гексокиназной реакции. Образование глюкозы из глюкозо-6 фосфата. Фермент – глюкозо-6-фосфатаза.
Полная схема глюконеогенеза из пирувата:
| Синтез глюкозы из лактата. Глюкозо-лактатный цикл (цикл Кори). |
Эту последовательность событий называют «глюкозо-лактатным циклом», или «циклом Кори». Цикл Кори выполняет 2 важнейшие функции: 1.) Обеспечивает утилизацию лактата, предотвращает накопление лактата и, как следствие этого, опасное снижение рН (лактоацидоз). 2.) Часть пирувата, образованного из лактата, окисляется печенью до СО2 и Н2О. Энергия окисления может использоваться для синтеза АТФ, необходимого для реакций глюконеогенеза.
Синтез глюкозы из аминокислот. В условиях голодания часть белков мышечной ткани распадается до аминокислот, которые далее включаются в процесс катаболизма. Гликогенные и смешанные аминокислоты могут использоваться для глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, которые вступают в реакцию переаминирования с пируватом. Аминогруппа переносится на пируват с образованием аланина. Аланин из мышц транспортируется кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюконеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват вмышцах → аланин в мышцах → аланин в печени → пируват в печени → глюкоза в печени → глюкоза в мышцах. Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает превращение пирувата в лактат, накопление которого опасно развитием лактацидоза.
| Аланиновая аминотрансфераза |
Синтез глюкозы из аминокислот (глюкозо-аланиновый цикл):
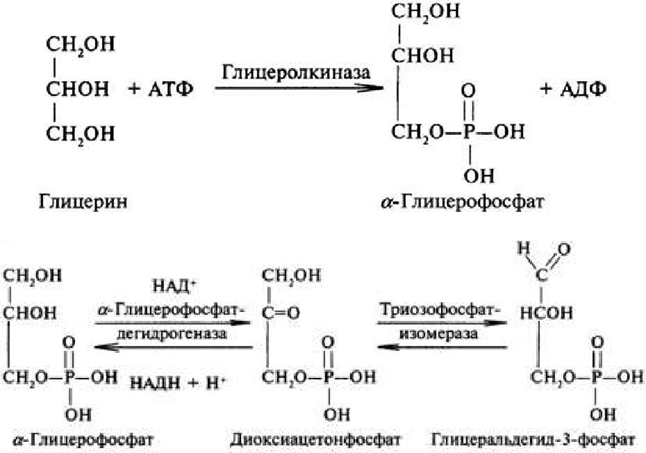
| Синтез глюкозы из глицерола: |
| Синтез глюкозы из глицерола. Глицерол образуется при гидролизе триацил-глицеролов, главным образом в жировой ткани. Использовать его могут только те ткани, в которых имеется фермент глицеролкиназа, например печень, почки. Этот АТФ-зависимый фермент катализирует превращение глицерола в α-глицерофосфат (глицерол-3-фосфат). При включении глицерол-3-фосфата в глюконеогенез происходит его дегидрирование NAD-зависимой дегидрогеназой с образованием дигидроксиацетонфосфата, который далее превращается в глицеральдегид-3-фосфат и включается в глюконеогенез. |
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
источник
Биосинтез гликогена в печени и мышцах: последовательность и химизм реакций, характеристика ферментов и продуктов. Регуляция обмена гликогена.
Гликоген способен синтезироваться почти во всех тканях, но наибольшие запасы гликогена находятся в печени и скелетных мышцах.
Накопление гликогена в мышцах отмечается в период восстановления после работы, особенно при приеме богатой углеводами пищи.
В печени гликоген накапливается только после еды, при гипергликемии. Такие отличия печени и мышц обусловлены наличием различных изоферментов гексокиназы, фосфорилирующей глюкозу в глюкозо-6-фосфат. Для печени характерен изофермент (гексокиназа IV), получивший собственное название – глюкокиназа. Отличиями этого фермента от других гексокиназ являются:
— низкое сродство к глюкозе, что ведет к захвату глюкозы печенью только при ее высокой концентрации в крови, продукт реакции (глюкозо-6-фосфат) не ингибирует фермент, в то время как в других тканях гексокиназа чувствительна к такому влиянию. Это позволяет гепатоциту в единицу времени захватывать глюкозы больше, чем он может сразу же утилизовать.
Благодаря особенностям глюкокиназы гепатоцит эффективно захватывает глюкозу после еды и впоследствии метаболизирует ее в любом направлении. При нормальных концентрациях глюкозы в крови ее захват печенью не производится.
Непосредственно синтез гликогена осуществляют следующие ферменты:
— Фосфоглюкомутаза – превращает глюкозо-6-фосфат в глюкозо-1-фосфат;


Регулирование: — Два гормона — адреналин и глюкагон — могут активировать фосфорилазу и таким образом ускорять процессы гликогенолиза. Начальные моменты влияний этих гормонов связаны с образованием в клетках циклического аденозинмонофосфатау который затем запускает каскад химических реакций, активирующих фосфорилазу.
— Адреналин выделяется из мозгового вещества надпочечников под влиянием активации симпатической нервной системы, поэтому одна из ее функций заключается в обеспечении обменных процессов. Эффект адреналина особенно заметен в отношении клеток печени и скелетных мышц, что обеспечивает наряду с влияниями симпатической нервной системы готовность организма к действию.
— Глюкагон — гормон, выделяемый альфа-клетками поджелудочной железы, когда концентрация глюкозы в крови снижается до слишком низких значений. Он стимулирует образование циклического АМФ главным образом в клетках печени, что, в свою очередь, обеспечивает превращение в печени гликогена в глюкозу и ее высвобождение в кровь, повышая таким образом концентрацию глюкозы в крови.
2. 
Реакция гликолитической оксидоредуктации= 6 реакции гликолиза превращение из ГАФ — 1,3 дифосфоглицерата.
Химизм: В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы НАД (НАДН). Эта реакция блокируется йод- или бромацетатом.

В анаэробных условиях, образовавшийся НАДН2 идет в реакцию образования из ПВК – молочной кислоты.
3. Охарактеризуйте цАМФ как посредник между гормонами и ферментами. Назовите гормоны и контролируемые ими ферменты, повышающие и снижающие содержание цАМФ. Как изменяется содержание глюкозы в крови под влиянием этих гормонов?
Циклический аденозинмонофосфат (цAMФ) — производное АТФ, выполняющее в организме роль вторичного посредника, использующегося для внутриклеточного распространения сигналов некоторых, которые не могут проходить через клеточную мембрану.
цAMФ осуществляет функции вторичного внутриклеточного посредника в действии первичных посредников — например, ряда гормонов и нейромедиаторов. цAMФ опосредует биологическую функцию гормонов путем активации (инактивации) клеточных протеинкиназ (фосфатаз). Протеинкиназы, в свою очередь, фосфорилируют эффекторные белки и изменяют (увеличивают или уменьшают) их активность.
При активации аденилатциклазы, катализирующей образование цAMФ из АТФ, или блокировании фосфодиэстеразы, осуществляющей деградацию этого цAMФ, концентрация цAMФ в клетке увеличивается. Таким образом, содержание цAMФ в клетке определяется соотношением активностей этих двух ферментов. Связь между гормоном или др. химическим сигналом (первый посредник) и цAMФ (второй посредник) осуществляет аденилатциклазный комплекс, включающий рецептор, настроенный на определённый гормон (или др. биологически активное вещество) и расположенный на внешней стороне клеточной мембраны, и аденилатциклазу, расположенную на внутренней стороне мембраны. Гормон, взаимодействуя с рецептором, активирует аденилатциклазу, которая образует цAMФ из АТФ.
— Инсулин – понижает концентрацию глюкозы в крови;
— Адреналин – вызывает резкое увеличение глюкозы в крови;
— Глюкагон и Кортизол– повышают уровень глюкозы в крови.
Последнее изменение этой страницы: 2016-04-06; Нарушение авторского права страницы
источник
Гликоген — основная форма депонирования углеводов у животных — синтезируется главным образом в печени, составляя до 6% от массы печени, и в мышцах, где его содержание редко превышает 1%.
Гликоген печени выполняет важную функцию в поддержании физиологической концентрации глюкозы в крови, прежде всего в промежутках между приемами пищи. Функция мышечного гликогена состоит в том, что он является легкодоступным источником глюкозы в самой мышце. Гликоген локализирован в цитозоле клеток в форме гранул, которые кроме гликогена содержат ферменты, участвующие в его обмене.
Следует обратить внимание, что распад и синтез гликогена катализируются разными ферментами и, следовательно, протекают по разным метаболическим путям.
Синтез гликогена начинается через 1—2 ч после приема пищи, содержащей углеводы. Процесс синтеза гликогена требует затраты энергии АТФ.
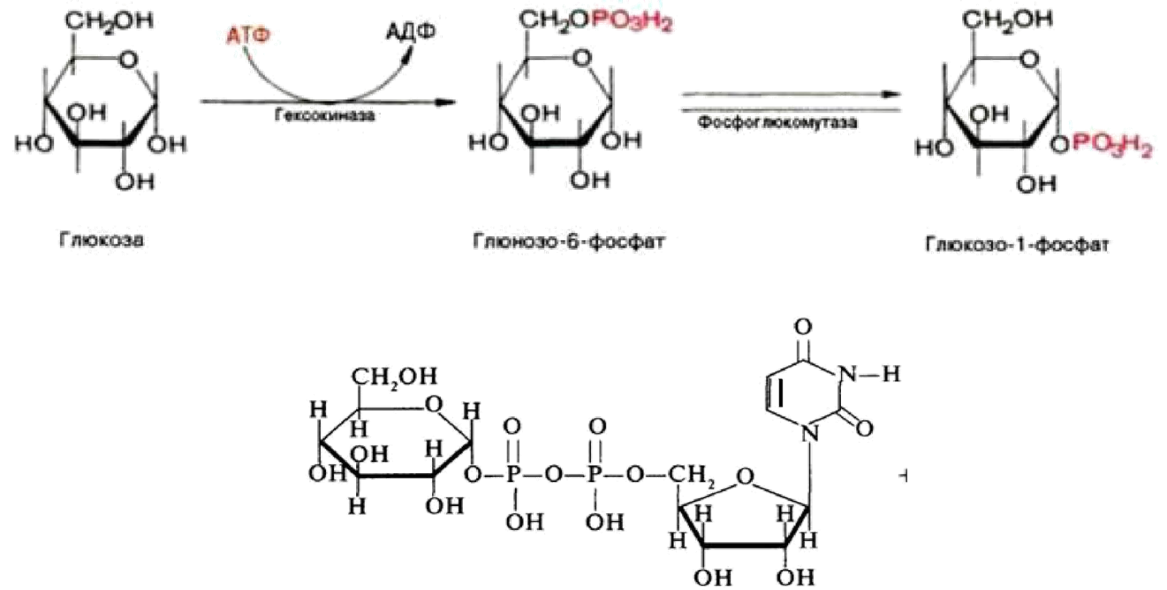
- 1. В этой реакции молекула АТФ затрачивается на фосфорилирование свободной глюкозы, в результате чего образуется глюкозо-6-фосфат. Это та же реакция, которая является первой в процессе гликолиза (гл. 18). Фосфорилирование глюкозы катализируется в мышцах гексокиназой, в печени — глюкокиназой.
- 2. Далее следует реакция изомеризации глюкозо-6-фосфага в глюкозо-1- фосфат, которая катализируется ферментом фосфоглюкомутазой:
3. Образовавшаяся фосфорилированная глюкоза уже непосредственно вовлекается в синтез гликогена. Однако предварительно она взаимодействует с УТФ, и при действии фермента глюкозо-1 -фосфатуридинтрансферазы (другое название УДФГ-пирофосфорилаза) образуется уридиндифосфатглюкоза (УДФ-глюкоза):
Структурная формула УДФ-глюкозы:
Рис. 20.5. Синтез гликогена
Образовавшаяся УДФ-глкжоза является переносчиком и донором активированных глюкозильных остатков в последующей ферментативной реакции синтеза гликогена. Эта функция нуклеозиддифосфатсахаров была установлена аргентинским биохимиком Л. Лелуаром, удостоенным Нобелевской премии за эти работы.
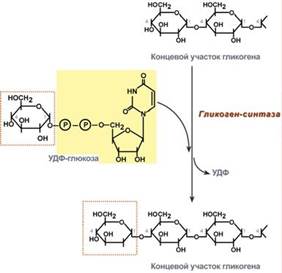
4. Реакция, приводящая к образованию гликогена, происходит при переносе глюкозного остатка, входящего в состав УДФ-глюкозы, на глико- зидную «затравочную» цепь гликогена.
При этом образуется а(1—>4)-глико- зидная связь между первым атомом углерода, добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозы в цепи гликогена. Эта реакция катализируется ферментом гликоген- синтазой (рис. 20.5).
Таким образом, в результате этой реакции происходит только удлинение цепи, т. е. она требует присутствия полиглюкозной «затравки»: самого гликогена, амилозы, амилопектина или какого-либо олигосахарида с длиной цепи не менее четырех глюкозных остатков и приводит к образованию линейного полимера а-1—*4-глюкана.
У растений донором глюкозильных групп при синтезе крахмала служит АДФ-Э-глюкоза, а не УДФ-производныс (гл. 16).
Ветвление цепей гликогена в результате образования а-1—? 6-связей (по одной на каждые 8—12 остатков, соединенных а-1—?4-связями) катализируется другим ферментом — а-глюкан-ветвящей глюкозилтрансферазой (известной также под названием «гл икогенветви щий фермент»). Этот фермент отщепляет небольшие фрагменты цепи 1,4-глюкана (шесть или семь мономерных единиц) и переносит их на ту же самую (или другую аналогичную) цепь, но в положение 6, в результате чего образуется 1,6-связь по схеме:
Регуляция гликогеногенеза. В гл. 18 приведена регуляция расщепления гликогена (гликогенолиза) посредством обратимой ковалентной химической модификации фермента гликогснфосфорилазы (фосфорилирование — дефосфорилирование). Гликогенсинтаза также существует в двух формах — фосфо- рилированной и дефосфорилированной, но она регулируется реципропно по отношению к гликогенфосфорилазе, т. е. прямо противоположным образом. В результате сложного каскада реакций фосфорилирование активной гли- когенсинтазы а приводит к переходу ее в фосфорилированную неактивную форму:
Протсинкиназа и протеинфосфатаза — это тс же самые ферменты, которые участвовали во взаимопревращении а- и 6-форм гликогенфосфори- лазы.
Таким образом, такие гормоны, как адреналин и глюкагон, действие которых опосредовано цАМФ, синхронно ингибируют синтез гликогена и активируют гликогенолиз, тем самым их гормональное воздействие приведет к повышению сахара в клетках печени и крови (рис. 20.6).
Следует отмстить, что в мышечной ткани рецепторы глюкагона отсутствуют и регуляторное действие этого гормона на обмен гликогена отмечено лишь в печени.
Известна также аллостерическая регуляция активности гликогснсинтазы Ь. Будучи фосфорилированным, этот фермент мало или полностью неактивен, однако глюкозо-6-фосфат (при высокой концентрации) по аллостерическому механизму в значительной степени повышает активность гликогенсинтазы. Эта форма гликогенсинтазы называется D-формой или зависимой (dependent) формой от присутствия глюкозо-6-фосфата. а дефосфорилированная форма — активной и в отсутствие глюкозо-6-фосфата — 1-формой или независимой (independent) от присутствия этого модулятора.
Рис. 20.6. Гормональная регуляция синтеза и деградации гликогена:
(Т)—(б) — каскад реакций последействия глюкагона и адреналина (сплошная линия); стимулирующее действие инсулина на синтез гликогена (пунктирная линия)
Активирующее действие на синтез гликогена в мышцах оказывает также инсулин, способствуя дефосфорилированию гликогенсинтазы за счет активации протеинфосфатазы, катализирующей реакцию дефосфорилирования этого фермента.
источник
Гликоген может синтезироваться практически во всех органах и тканях. Большая часть гликогена содержится в мышцах.
Глюкоза из крови легко проникает в клетки органов и тканей, проходя через биологические мембраны клеток. Как только глюкоза заходит в клетку, она превращается в глюкозо-6-фосфат. Процесс биосинтеза протекает в 4 стадии:
ГЛИКОГЕНСИНТАЗА — ТРАНСФЕРАЗА, которая переносит остатки глюкозы, входящие в УДФ- глюкозу, на ГЛИКОЗИДНУЮ связь остаточного в клетке гликогена. Образование альфа(1,6)-ГЛИКОЗИДНЫХ связей катализирует специальный ГЛИКОГЕН-ВЕТВЯЩИЙ фермент. Образовавшийся в последней реакции УДФ, превращается в УТФ, при этом поглощается I молекула АТФ. Гликоген в клетках накапливается во время пищеварения и рассматривается как резервная форма глюкозы, которая используется клетками в промежутках между приёмами пищи.
РАСПАД ГЛИКОГЕНА. Может идти 2 путями:
1. ОСНОВНОЙ ФОСФОРОЛИТИЧЕСКИЙ ПУТЬ
Он протекает в печени, почках, эпителии кишечника. Схематично можно записать в виде 3 реакций.
2.НЕОСНОВНОЙ АМИЛОЛИТИЧЕСКИЙ. Его доля незначительна. Протекает в печени при участии 3 ферментов: альфа — АМИЛАЗА, АМИЛО-1,6-ГЛИКОЗИДАЗА, гамма -АМИЛАЗА.
Это наследственное нарушение обмена гликогена, которое связано с недостатком какого-либо из ферментов, участвующих в синтезе или распаде гликогена. ГЛИКОГЕНОЗЫ — болезни, связанные с нарушением процессов распада гликогена. Клинически проявляются увеличением печени, мышечной слабостью, ГИПОГЛЮКОЗЭМИЕЙ натощак. Наиболее часто встречаются:
1.болезнь ФЕРСА — ФОСФОРИЛАЗА ПЕЧЕНИ.
2. Болезнь МАК-АРДЛЯ — ФОСФОРИЛАЗА МЫШЦ.
3. Болезнь ПОМПЕ- альфа- 1,4-ГЛИКОЗИДАЗА.
4. Болезнь КОРИ — АМИЛО-1.6-ГЛИКОЗИДАЗА.
5. Болезнь ГИРКЕ — ГЛЮКОЗО-6-ФОСФОТАЗА.
АГЛИКОГЕНОЗЫ характеризуются признаками нарушения синтеза. Клинически проявляются резкой ГИПОГЛЮКОЗЭМИЕЙ натощак, рвотой, судорогами, потерей сознания. Наиболее часто встречаются:
1. болезнь ЛЬЮИСА — ГЛИКОГЕНСИНТЕТАЗА.
2. Болезнь АНДЕРСЕНА — ГЛИКОГЕН-ВЕТВЯЩИЙ фермент.
38. Пути образования глюкозы в организме. Глюконеогенез. Возможные предшественники, последовательность реакций, биологическая роль.
ГЛЮКОНЕОГЕНЕЗ — это биосинтез глюкозы из неуглеводных предшественников, главными из которых являются ПИРУВАТ, ЛАКТАТ, ГЛИЦЕРИН, ряд АК, тем или иным путем превращающиеся в ФУМАРАТ, который в дальнейшем превращается в ЩУК. Другие АК превращаются в ПИРУВАТ. Главным местом синтеза глюкозы является печень. ГЛЮКОНЕОГЕНЕЗ обеспечивает синтез глюкозы, а также возврат ЛАКТАТА, образованного в реакциях анаэробного ГЛИКОЛИЗА, в клеточный фонд углеводов. За счет этого процесса поддерживается уровень глюкозы при углеводном голодании, сахарном диабете. Большинство реакций ГЛЮКОНЕОГЕНЕЗА представляют собой обратные реакции ГЛИКОЛИЗУ, за исключением трёх (ГЕКСОКИНАЗНОЙ, ФОСФОФРУКТОКИНАЗНОЙ, ПИРУВАТКИНАЗНОЙ), которые при ГЛюКОНЕОГЕНЕЗЕ имеют обходные пути.
Первая обходная реакция ГЛЮКОНЕОГЕНЕЗА связана с образованием 2-ФОСФОЕНОЛ ПВК и протекает в две стадии:
Вторая обходная реакция связана с образованием фруктозо-6-фосфата.
Образовавшаяся глюкоза может вновь использоваться клетками как пластический и энергетический материал, откладываться про запас в виде гликогена. В организме взрослого человека за сутки может быть образованно 80 гр. глюкозы.
источник