
Кость Широкая решила рассказать вам все самое важное и нужное о гликогене, чтобы больше не верили в миф о том, что «сжигание жиров начинается только после 20 минуты бега». Заинтриговали?
Итак, из этой статьи вы узнаете: что такое гликоген, строение и биологическую роль, его свойства, а также формулу и структуру строения, где и для чего содержится гликоген, как происходит синтез и распад вещества, как происходит обмен, а также, какие продукты являются источником гликогена.
Нашему телу еда в первую очередь нужна как источник энергии, а уже потом, как источник удовольствия, антистрессовый щит или возможность «побаловать» себя. Как известно, энергию мы получаем из макронутриентов: жиров, белков и углеводов.
Жиры дают 9 ккал, а белки и углеводы — 4 ккал. Но не смотря на большую энергетическую ценность жиров и важную роль незаменимых аминокислот из белков важнейшими «поставщиками» энергии в наш организм являются углеводы.
Почему? Ответ прост: жиры и белки являются «медленной» формой энергии, т.к. на их ферментацию требуется определенное время, а углеводы — относительно «быстрой». Все углеводы (будь то конфета или хлеб с отрубями) в конце концов расщепляются до глюкозы, которая необходима для питания всех клеток организма.

Гликоген — это своеобразный «консервант» углеводов, другими словами, энергетические резервы организма — сохраненная про запас для последующих энергетических нужд глюкоза. Она хранится в связанном с водой состоянии. Т.е. гликоген — это «сироп» калорийностью 1-1.3 ккал/гр (при калорийности углеводов 4 ккал/г).
По сути, молекула гликогена состоит из остатков глюкозы, это запасное вещество на случай нехватки энергии в организме!
Структурная формула строения фрагмента макромолекулы гликогена (C6H10O5) выглядит схематично так:
Вообще, гликоген — это полисахарид, а значит, относится к классу «сложных» углеводов:
В гликоген может пойти только углевод. Поэтому крайне важно держать в своем рационе планку углеводов не ниже 50 % от общей калорийности. Употребляя нормальный уровень углеводов (около 60% от суточного рациона) вы по максимуму сохраняете собственный гликоген и заставляете организм очень хорошо окислять углеводы.
Важно иметь в рационе хлебобулочные изделия, каши, злаки, разные фрукты и овощи.
Лучшими источниками гликогена являются: сахар, мед, шоколад, мармелад, варенье, финики, изюм, инжир, бананы, арбуз, хурма, сладкая выпечка.
Осторожно к подобной пище стоит отнестись лицам с дисфункцией печени и недостатком ферментов.
Как же происходит создание и процесс распад гликогена?
Как организм запасает гликоген? Процесс образования гликогена (гликогенез) проходит по 2 сценариям. Первый — это процесс запаса гликогена. После углеводосодержащей еды уровень глюкозы в крови повышается. В ответ инсулин попадает в кровоток, чтобы впоследствии облегчить доставку глюкозы в клетки и помочь синтезу гликогена.
Благодаря ферменту (амилазе) происходит расщепление углеводов (крахмала, фруктозы, мальтозы, сахарозы) на более мелкие молекулы.
Затем под воздействием ферментов тонкого кишечника осуществляется распад глюкозы на моносахариды. Значительная часть моносахаридов (самая простая форма сахара) поступает в печень и мышцы, где гликоген откладывается в «резерв». Всего синтезируется 300-400 гр гликогена.
Т.е. само превращение глюкозы в гликоген (запасной углевод) происходит в печени, т.к. мембраны клеток печени в отличие от мембраны клеток жировой ткани и мышечных волокон свободно проницаемы для глюкозы и в отсутствие инсулина.
Второй механизм под названием мобилизация (или распад) запускается в периоды голода или активной физической деятельности. По мере необходимости гликоген мобилизуется из депо и превращается в глюкозу, которая поступает к тканям и используется ими в процессе жизнедеятельности.
Когда организм истощает запас гликогена в клетках, то мозг подает сигналы о необходимости «дозаправки». Схема синтеза и мобилизации гликогена:
Кстати, при распаде гликогена происходит торможение его синтеза, и наоборот: при активном образовании гликогена его мобилизация тормозится. Гормоны, отвечающие за мобилизацию данного вещества, т.е., гормоны, стимулирующие распад гликогена — это адреналин и глюкагон.
Где накапливается гликоген для последующего использования:
Основные запасы гликогена находятся в печени и мышцах. Количество гликогена в печени может достигать у взрослого человека 150 — 200 гр. Клетки печени являются лидерами по накоплению гликогена: они могут на 8 % состоять из этого вещества.
Основная функция гликогена печени — поддержать уровень сахара в крови на постоянном, здоровом уровне.
Печень сама себе является одним из важнейших органов организма (если вообще стоит проводить «хит парад» среди органов, которые нам все необходимы), а хранение и использование гликогена делает ее функции еще ответственнее: качественное функционирование головного мозга возможно только благодаря нормальному уровню сахара в организме.
Если же уровень сахара в крови снижается, то возникает дефицит энергии, из-за которого в организме начинается сбой. Нехватка питания для мозга сказывается на центральной нервной системе, которая истощается. Тут то и происходит расщепление гликогена. Потом глюкоза поступает в кровь, благодаря чему организм получает необходимое количество энергии.
Запомним также, что в печени происходит не только синтез гликогена из глюкозы, но и обратный процесс — гидролиз гликогена до глюкозы. Этот процесс вызывается понижением концентрации сахара в крови в результате усвоения глюкозы различными тканями и органами.
Гликоген откладывается также в мышцах. Общее количество гликогена в организме составляет 300 — 400 граммов. Как мы знаем, около 100-120 граммов вещества накапливается в клетках печени, а вот остальная часть (200-280 гр) сохраняется в мышцах и составляет максимум 1 — 2% от общей массы этих тканей.
Хотя если говорить максимально точно, то следует отметить, что гликоген хранится не в мышечных волокнах, а в саркоплазме — питательной жидкости, окружающей мышцы.
Количество гликогена в мышцах увеличивается в случае обильного питания и уменьшается во время голодания, а снижается только во время физической нагрузки – длительной и/или напряженной.
При работе мышц под влиянием специального фермента фосфорилазы, которая активируется в начале мышечного сокращения, происходит усиленное распад гликогена в мышцах, который используется для обеспечения глюкозой работы самих мышц (мышечных сокращений). Таким образом, мышцы используют гликоген только для собственных нужд.
Интенсивная мышечная деятельность замедляет всасывание углеводов, а легкая и непродолжительная работа усиливает всасывание глюкозы.
Гликоген печени и мышц используется для разных нужд, однако говорить о том, что какой-то из них важнее — абсолютнейший вздор и демонстрирует только вашу дикую неграмотность.

Все, что написано на данном скрине, полная ересь. Если вы боитесь фруктов и думаете, что они прямиком запасаются в жир, то никому не говорите этой чуши и срочно читайте статью Фруктоза: можно ли есть фрукты и худеть?
Важно знать, почему работают низкоуглеводные высокобелковые диеты. В организме взрослого может находиться около 400 граммов гликогена, а как мы помним, на каждый грамм резервной глюкозы приходится примерно 4 грамма воды.
Т.е. около 2 кг вашего веса — это масса гликогенного водного раствора. Кстати, поэтому мы активно потеем в процессе тренировок — организм расщепляет гликоген и при этом теряет в 4 раза больше жидкости.
Этим свойством гликогена объясняется и быстрый результат экспресс-диет для похудения. Безуглеводные диеты провоцируют интенсивное израсходование гликогена, а с ним – жидкости из организма. Но как только человек возвращается к обычному рациону с содержанием углеводов, запасы животного крахмала восстанавливаются, а с ними и потерянная за период диеты жидкость. В этом и кроется причина недолгосрочности результата экспресс-похудения.
Для любых активных физических нагрузок (силовые упражнения в тренажерном зале, бокс, бег, аэробика, плавание и все, что заставляет вас потеть и напрягаться) организму нужно 100-150 граммов гликогена в каждый час активности. Потратив запасы гликогена, тело начинает разрушать сперва мышцы, затем жировую ткань.
Обратите внимание: если речь идет не о длительном полном голодании, запасы гликогена не истощаются полностью, потому что имеют жизненно важное значение. Без запасов в печени мозг может остаться без снабжения глюкозой, а это смертельно опасно, ведь мозг самый главный орган (а не попа, как некоторые думают).
Без запасов в мышцах сложно совершить интенсивную физическую работу, что в природе воспринимается как повышенный шанс быть съеденным/без потомства/замерзшим и т.д.
Тренировки истощают запасы гликогена, но не по схеме «первые 20 минут работаем на гликогене, потом переходим на жиры и худеем».
Для примера возьмем исследование, в котором тренированные атлеты выполняли 20 сетов упражнений на ноги (4 упражнения, 5 сетов каждого; каждый сет выполнялся до отказа и составлял 6-12 повторений; отдых был коротким; общее время тренировки составило 30 минут).
Кто знаком с силовыми тренировками, понимает, что было отнюдь не легко. До и после упражнения у них брали биопсию и смотрели содержание гликогена. Оказалось, что количество гликогена снизилось с 160 до 118 ммоль/кг, т. е. менее, чем на 30%.
Вот так походя мы развеяли еще один миф — вряд ли за тренировку вы успеете исчерпать все запасы гликогена, так что не стоит набрасываться на еду прямо в раздевалке среди потных кроссовок и посторонних тел, вы явно не помрете от «неминуемого» катаболизма.
Кстати, пополнять запасы гликогена стоит не в течении 30 минут после тренировки ( увы, белково-углеводное окно – миф ), а в течении 24 часов.
Люди крайне преувеличивают скорость истощения гликогена (как и многие другие вещи)! Любят сразу на тренировке закинуться «углями» после первого разминочного подхода с грифом пустым, а то ж «истощение мышечного гликогена и КАТАБОЛИЗМ». Прилег на час днем и усе, печеночного гликогена как не бывало.
Мы уж молчим про катастрофические энергозатраты от 20минутного черепашьего бега. Да и вообще, мышцы жрут чуть не 40 ккал на 1 кг, белок гниет, образует слизь в жкт и провоцирует рак, молочка заливает так, что аж 5 лишних кило на весах (не жира, ага), жиры вызывают ожирение, углеводы смертельно опасны (боюсь-боюсь) и от глютена вы точно помрете.
Странно только, что мы вообще ухитрились выжить в доисторические времена и не вымерли, хотя питались явно не амброзией и спортпитом.
Помните, пожалуйста, что природа умнее нас и давно все при помощи эволюции отрегулировала. Человек один из самых адаптированных и приспосабливаемых организмов, который способен существовать, размножаться, выживать. Так что без психозов, господа и дамы.
Однако тренироваться на пустой желудок более чем бессмысленно.»Что же делать?» подумаете вы. Ответ вы узнаете в статье «Кардио: когда и зачем?» , которая расскажет вам о последствиях голодных тренировок.
Гликоген печени расщепляется при снижении концентрации глюкозы в крови, прежде всего между приемами пищи. Через 48-60 часов полного голодания запасы гликогена в печени полностью истощаются.
Гликоген мышц расходует во время физической активности. И тут мы опять вернемся к мифу: «Чтобы сжечь жир, нужно бегать не менее 30 минут, поскольку только на 20-й минуте в организме истощаются запасы гликогена и в качестве топлива начинает использоваться подкожный жир», только с чисто математической стороны. Откуда это пошло? А пес его знает!
Действительно, организму проще использовать гликоген, чем окислять жир для энергии, поэтому в первую очередь расходуется он. Отсюда и миф: надо сначала израсходовать ВЕСЬ гликоген, и потом жир начнет гореть, а произойдет это примерно через 20 минут после начала аэробной тренировки. Почему 20? Понятия не имеем.
НО: никто не учитывает, что использовать весь гликоген не так-то просто и 20-ю минутами тут дело не ограничится.
Как мы знаем, общее количество гликогена в организме составляет 300 — 400 граммов, а в некоторых источниках говорится о 500 граммах, что дает нам от 1200 до 2000 ккал! Вы вообще представляете, сколько нужно бегать, чтобы истощить такую прорву калорий? Человек весом в 60 кг должен будет пробежать в среднем темпе от 22 до З5 километров. Ну как, готовы?

источник
Коэффициент фосфорилирования
В расчете на каждый атом поглощенного кислорода (или на каждую пару переносимых электронов) митохондрии образуют максимум три молекулы АТФ (т. е. связывают три молекулы Н3Р04 с АДФ). Отношение количества связанной Н3Р04к( Скачано с dsmahelp.org.ua) количеству поглощенного кислорода (О) называют коэффициентом фосфорили-рования и обозначают Р/О; следовательно, коэффициент Р/О
Весь катаболизм условно подразделяется на три этапа:
Происходит в кишечнике (переваривание пищи) или в лизосомах при расщеплении уже ненужных молекул. При этом освобождается около 1% энергии, заключенной в молекуле. Она рассеивается в виде тепла.
Вещества, образованные при внутриклеточном гидролизе или проникающие в клетку из крови, на втором этапе обычно превращаются в пировиноградную кислоту, ацетильную группу (в составе ацетил-S-КоА) и в некоторые другие мелкие органические молекулы. Локализация второго этапа – цитозоль и митохондрии.
Часть энергии рассеивается в виде тепла и примерно 13% энергии вещества усваивается, т.е. запасается в виде макроэргических связей АТФ.
Все реакции этого этапа идут в митохондриях. Ацетил-SКоА включается в реакции цикла трикарбоновых кислот и окисляется до углекислого газа. Выделенные атомы водорода соединяются с НАД и ФАД и восстанавливают их. После этого НАДН и ФАДН2 переносят водород в цепь дыхательных ферментов, расположенную на внутренней мембране митохондрий. Здесь в результате процесса под названием «окислительное фосфорилирование» образуется вода и главный продукт биологического окисления – АТФ.
Часть выделенной на этом этапе энергии молекулы рассеивается в виде тепла и около 46% энергии исходного вещества усваивается, т.е. запасается в связях АТФ и ГТФ.
7. Ци́кл трикарбо́новых кисло́т (цикл Кре́бса, цитра́тный цикл) — центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух- и трёхуглеродных соединений, образующихся как промежуточные продукты в живых организмах при распаде углеводов, жиров и белков, до CO2. При этом освобождённый водород направляется в цепь тканевого дыхания, где в дальнейшем окисляется до воды, принимая непосредственное участие в синтезе универсального источника энергии — АТФ.
Цикл Кребса регулируется «по механизму отрицательной обратной связи», при наличии большого количества субстратов (ацетил-КоА, оксалоацетат), цикл активно работает, а при избытке продуктов реакции (NADH, ATP) тормозится. Регуляция осуществляется и при помощи гормонов, основным источником ацетил-КоА является глюкоза, поэтому гормоны, способствующие аэробному распаду глюкозы, способствуют работе цикла Кребса. Такими гормонами являются: инсулин и адреналин. Глюкагон стимулирует синтез глюкозы и ингибирует реакции цикла Кребса.
Как правило работа цикла Кребса не прерывается за счёт анаплеротических реакций, которые пополняют цикл субстратами: Пируват + СО2 + АТФ = Оксалацетат(субстрат Цикла Кребса) + АДФ + Фн.
Интегративная функция — цикл является связующим звеном между реакциями анаболизма и катаболизма.
· Катаболическая функция — превращение различных веществ в субстраты цикла:
· Жирные кислоты, пируват,Лей,Фен — Ацетил-КоА.
Арг, Гис, Глу — α-кетоглутарат.
· Анаболическая функция — использование субстратов цикла на синтез органических веществ:
Оксалацетат — глюкоза, Асп, Асн.
CО2 — реакции карбоксилирования.
· Водорододонорная функция — цикл Кребса поставляет на дыхательную цепь митохондрий протоны в виде трех НАДН.Н+ и одного ФАДН2.
· Энергетическая функция — 3 НАДН.Н+ дает 7.5 моль АТФ, 1 ФАДН2 дает 1.5 моль АТФ на дыхательной цепи. Кроме того в цикле путем субстратного фосфорилирования синтезируется 1 ГТФ, а затем из него синтезируется АТФ посредствам трансфосфорилирования: ГТФ + АДФ = АТФ + ГДФ.
8. Глико́лиз— ферментативный процесс последовательного расщепления глюкозы в клетках, сопровождающийся синтезом АТФ. Гликолиз при аэробных условиях ведёт к образованию пировиноградной кислоты (пирувата), гликолиз в анаэробных условиях ведёт к образованию молочной кислоты (лактата). Гликолиз является основным путём катаболизма глюкозы в организме животных.
Результатом гликолиза является превращение одной молекулы глюкозы в две молекулы пировиноградной кислоты (ПВК) и образование двух восстановительных эквивалентов в виде кофермента НАД∙H.
Полное уравнение гликолиза имеет вид:
Глюкоза + 2НАД+ + 2АДФ + 2Фн = 2НАД∙Н + 2ПВК + 2АТФ + 2H2O + 2Н+.
При отсутствии или недостатке в клетке кислорода пировиноградная кислота подвергается восстановлению до молочной кислоты, тогда общее уравнение гликолиза будет таким:
Глюкоза + 2АДФ + 2Фн = 2лактат + 2АТФ + 2H2O.
Таким образом, при анаэробном расщеплении одной молекулы глюкозы суммарный чистый выход АТФ составляет две молекулы, полученные в реакциях субстратного фосфорилирования АДФ.
У аэробных организмов конечные продукты гликолиза подвергаются дальнейшим превращениям в биохимических циклах, относящихся к клеточному дыханию. В итоге после полного окисления всех метаболитов одной молекулы глюкозы на последнем этапе клеточного дыхания — окислительном фосфорилировании, происходящем на митохондриальной дыхательной цепи в присутствии кислорода, — дополнительно синтезируются ещё 34 или 36 молекулы АТФ на каждую молекулу глюкозы.
Гликолиз — катаболический путь исключительной важности. Он обеспечивает энергией клеточные реакции, в том числе и синтез белка. Промежуточные продукты гликолиза используются при синтезе жиров. Пируват также может быть использован для синтеза аланина, аспартата и других соединений. Благодаря гликолизу производительность митохондрий и доступность кислорода не ограничивают мощность мышц при кратковременных предельных нагрузках.
9. Глюкозо-лактатный цикл (цикл Кори) —Начинается с образования лактата в мышцах в результате анаэробного гликолиза (особенно в белых мышечных волокнах, которые бедны митохондриями по сравнению с красными). Лактат переносится кровью в печень, где в процессе глюконеогенеза превращается в глюкозу, которая затем с током крови может возвращаться в работающую мышцу.
Итак печень снабжает мышцу глюкозой и, следовательно, энергией для сокращений. В печени часть лактата может окисляться до СО2 и Н2О, превращаясь в пируват и далее в общих путях катаболизма.
Аланин (2-аминопропановая кислота) — алифатическая аминокислота.
α-Аланин входит в состав многих белков, β-аланин — в состав ряда биологически активных соединений.
Аланин легко превращается в печени в глюкозу и наоборот. Этот процесс носит название глюкозо-аланинового цикла и является одним из основных путей глюконеогенеза в печени.
взаимодействие с основаниями
NH2-C2H4-COOH + NaOH → NH2-C2H4-COONa + H2O
взаимодействие с кислотами
NH2-C2H4-COOH + HCl → HOOC-C2H4-NH2•HCl
взаимодействие со спиртами
NH2-C2H4-COOH + C2H5OH → NH2-C2H4-CO-С2Н5 + H2O
образование пептидной связи
NH2-C2H4-COOH + NH2-C2H4-COOH → NH2-C2H4-CO-NH-C2H4-COOH + H2O
10. Обмен гликогена
Гликоген обнаруживается в цитоплазме и ядрах клеток в виде прозрачных капель. Он хорошо растворим в воде. Поэтому ткани, исследуемые па гликоген, необходимо предохранять от воздействия водных растворов и фиксировать в безводном спирте, ацетоне и др. Правильнее говорить не о гликогене, а о гликогенах с различной степенью полимеризации и растворимости. В связи с этим возникают трудности в гистохимическом его изучении.
Непосредственно синтез гликогена осуществляют следующие ферменты:
1. Фосфоглюкомутаза – превращает глюкозо-6-фосфат в глюкозо-1-фосфат;
2. Глюкозо-1-фосфат-уридилтрансфераза – фермент, осуществляющий ключевую реакцию синтеза. Необратимость этой реакции обеспечивается гидролизом образующегося дифосфата;
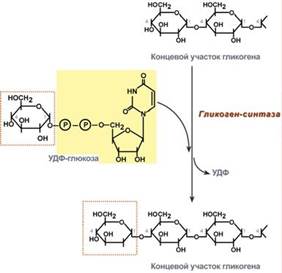
3. Гликогенсинтаза – образует α1,4-гликозидные связи и удлиняет гликогеновую цепочку, присоединяя активированный С1 УДФ-глюкозы к С4 концевых остатков гликогена;
4. Амило-α1,4-α1,6-гликозилтрансфераза,»гликоген-ветвящий» фермент – переносит фрагмент с минимальной длиной в 6 остатков глюкозы на соседнюю цепь с образованием α1,6-гликозидной связи.
Фермент фосфорилаза, регулирующий распад гликогена, существует в двух формах: неактивной фосфорилазы b и высокоактивной фосфорилазы a. Превращение неактивной фосфорилазы b в активную фосфорилазу a происходит в результате реакции переноса фосфатной группы с АТФ на OH-группу серина — одной из аминокислот в белковой цепи фермента. Для этой реакции переноса необходим еще один фермент — специфическая киназа, а также специфический кофактор — циклическая адениловая кислота. Подготовительным этапом при активации фосфорилазы является образование из АТФ циклической адениловой кислоты; эта реакция происходит при участии фермента аденилциклазы, связанной с мембранами клеток. Активность аденилциклазы стимулируется гормонами адреналином или глюкагоном. Благодаря этому сложному механизму оба гормона вызывают повышение содержания сахара в крови млекопитающих.
Биологическое значение обмена гликогена в печени и мышцах
Сравнение этих процессов позволяет сделать следующие выводы:
· синтез и распад гликогена протекают по разным метаболическими путям;
· печень запасает глюкозу в виде гликогена не столько для собственных нужд, сколько для поддержания постоянной концентрации глюкозы в крови, и, следовательно, обеспечивает поступление глюкозы в другие ткани. Присутствие в печени глюкозо-6-фосфатазы обусловливает эту главную функцию печени в обмене гликогена;
· функция мышечного гликогена заключается в освобождении глюкозо-6-фосфата, потребляемого в самой мышце для окисления и использования энергии;
· синтез гликогена — процесс эндергонический. Так на включение одного остатка глюкозы в полисахаридную цепь используется 1 моль АТФ и 1 моль УТФ;
· распад гликогена до глюкозо-6-фосфата не требует энергии;
· необратимость процессов синтеза и распада гликогена обеспечивается их регуляцией.
11. Пентозо-фосфатный путь расщепления глюкозы:протекает в цитоплазме клеток и включает две стадии: 1) окислительная 2)неокислительная.
В ходе окислительноо этапа образуются НАДФН, а также фосфорилированные пентозы.
Неокислительная стадия: в ней происходит превращение пентоз, при этом образуются промежуточные продукты С3,С4,С6 углеродных атомов. В пентозо-фосфатном пути, в который вступают 6 молекул глюкозы, одна расщепляется до СО2, а остальные регенирируются.
1. Глюкозо-6-фосфат + 6 НАДФ = 6-Фосфоглюко-нолактон + 6 НАДФН + 6Н+
3. 6-Фосфоглюконат + 6 НАДФ=6 Риболозо-5-фосфат + 6 НАДФН + 6 H+ + 6CO2
4. 2 Рибулозо-5-фосфат=2 Рибозо-5-фосфат
5. 4 Рибулозо-5-фосфат = 4 2-Ксилулозо-5-фосфат
Значение пентозо-фосфатного пути: Образование пентозы используется для синтеза нуклеотканных коферментов, мононуклеотидов( АМФ, УМФ, ЦМФ, ТМФ) и нуклеиновых кислот.
Пентозо-фосфатный путь сост. 50% НАДФН необходимого организму. ПФП наиболее активен в печени, жировой ткани, коре надпочечников, щитовидной железе, эритроцитах.
Распад жирных кислот
Жирные кислоты в виде триглицеридов накапливаются в жировых тканях. При потребности под действием таких веществ как адреналин, норадреналин, глюкагон и адренокортикотропина запускается процесс липолиза. Освобождённые жирные кислоты выделяются в кровоток, по которому попадают к нуждающимся в энергии клеткам, где сперва при участии АТФ происходит связывание (активация) с коферментом А (КоА). При этом АТФ гидролизуется до АМФ с освобождением двух молекул неорганического фосфата (Pi).
R-COOH + КоА-SH + АТФ → R-CO-S-КоА + 2Pi + H+ + АМФ
Синтез жирных кислот протекает в цитозоле из Ацетил-КоА, образовавшегося в митохондриях при гликолизе. Для использования ацетилкоэнзима-А в процессах, протекающих в цитоплазме клетки, протекает ряд реакций для переноса Ацетил-КоА через митохондриальную мембрану.
В митохондриях ацетил-КоА взаимодействует со Щавелевоуксусной кислотой (ЩУК), образуется лимонная кислота. В цитоплазме протекает обратный процесс. Таким образом, в цитоплазме образуется Ацетил-КоА.Для синтеза жирных кислот протекает еще ряд последовательных реакций, образуется малонил-КоА. Ацетильная и малонильная группы переносятся на АПБ при участии ацетил-и малонил-трансацилаз. АПБ — ацилпереносящий белок. Далее к Ацетил-АПБ прибавляется Малонил-АПБ с образованием Ацетоацетил-АПБ. Наступает цакл реакций, противоположных бета-окислению жирных кислот, но вместо КоА носителем является АПБ, а вместо НАД и ФАД в процессах гидрирования участвует НАДФН2.
Бутирил-АПБ вступает в новый цикл (взаимодействует с малонил-АПБ), в результате которого углеродная цепь удлиняется на 2 атома. Циклы повторяются, пока цепь включит 16 атомов углерода (пальмитиновая кислота) или большего четного числа.
источник
Гликоген — полисахарид на основе глюкозы, выполняющий в организме функцию энергетического резерва. Формально соединение относится к сложным углеводам, встречается только в живых организмах и предназначено для восполнения затрат энергии при физических нагрузках.
Из статьи вы узнаете о функциях гликогена, особенностях его синтеза, роли, которую играет это вещество в спорте и диетическом питании.
Говоря простым языком, гликоген (в особенности для спортсмена) – это альтернатива жирным кислотам, которая используется в качестве запасающего вещества. В чем суть? Все просто: мышечных клетках есть специальные энергетические структуры — «гликогеновые депо». В них хранится гликоген, который в случае необходимости быстро распадается на простейшую глюкозу и питает организм дополнительной энергией.
Фактически, гликоген – это основные батарейки, которые используются исключительно для совершения движений в стрессовых условиях.
Прежде чем рассматривать пользу гликогена как сложного углевода, разберемся, почему вообще в организме возникает такая альтернатива — гликоген в мышцах или жировые ткани. Для этого рассмотрим структуру вещества. Гликоген – это соединение из сотен молекул глюкозы. Фактически это чистый сахар, который нейтрализован и не попадает в кровь, пока организм сам его не запросит.
Синтезируется гликоген в печени, которая перерабатывает поступающий сахар и жирные кислоты по своему усмотрению.
Что же такое жирная кислота, которая получается из углеводов? Фактически – это более сложная структура, в которой участвуют не только углеводы но и транспортирующие белки. Последние связывают и уплотняют глюкозу до более трудно расщепляемого состояния. Это позволяет в свою очередь увеличить энергетическую ценность жиров (с 300 до 700 ккал) и уменьшить вероятность случайного распада.
Все это делается исключительно для создания резерва энергии в случае серьезного дефицита калорий. Гликоген же накапливается в клетках, и распадается на глюкозу при малейшем стрессе. Но и синтез его значительно проще.
Сколько гликогена может содержать организм? Здесь все зависит от тренировки собственных энергетических систем. Изначально размер гликогенового депо нетренированного человека минимален, что обусловлено его двигательными потребностями.
В дальнейшем, через 3-4 месяца интенсивных высокообъемных тренировок, гликогеновое депо под воздействием пампинга, насыщения крови и принципа супервосстановления постепенно увеличивается.
При интенсивном и продолжительном тренинге запасы гликогена увеличиваются в организме в несколько раз.
Что в свою очередь приводит к таким результатам:
- возрастает выносливость;
- объём мышечной ткани увеличивается;
- наблюдаются значительные колебания в весе во время тренировочного процесса
Гликоген не влияет напрямую на силовые показатели спортсмена. Кроме того, чтобы увеличивать размер гликогенового депо, нужны специальные тренировки. Так, например, пауэрлифтеры лишены серьезных запасов гликогена в виду и особенностей тренировочного процесса.
Обмен гликогена происходит в печени. Её основная функция — не превращение сахара в полезные нутриенты, а фильтрация и защита организма. Фактически, печень негативно реагирует на повышение сахара в крови, появление насыщенных жирных кислот и физические нагрузки.
Все это физически разрушает клетки печени, которые, к счастью, регенерируют. Чрезмерное потребление сладкого (и жирного), в совокупности с интенсивными физическими нагрузками чревато не только дисфункцией поджелудочной железы и проблемами с печенью, но и серьёзными нарушениями обмена веществ со стороны печени.
Организм всегда пытается адаптироваться к изменяющимся условиям с минимальной энергопотерей. Если создать ситуацию, при которой печень (способная переработать не более 100 грамм глюкозы за раз), будет хронически испытывать переизбыток сахара, то новые восстановленные клетки будут превращать сахар напрямую в жирные кислоты, минуя стадию гликогена.
Этот процесс называется «жировое перерождение печени». При полном жировом перерождении наступает гепатит. Но частичное перерождение считается нормой для многих тяжелоатлетов: такое изменение роли печени в синтезе гликогена приводит к замедлению обмена веществ и появлению избыточной жировой прослойки.
Гликоген в организме выполняет задачу главного энергоносителя. Он накапливается в печени и мышцах, откуда напрямую попадает в кровеносную систему, обеспечивая нас необходимой энергией.
Рассмотрим, как напрямую влияет гликоген на работу спортсмена:
- Гликоген быстро истощается благодаря нагрузкам. Фактически за одну интенсивную тренировку можно растратить до 80% всего гликогена.
- Это в свою очередь вызывает «углеводное окно», когда организм требует быстрых углеводов, для восстановления.
- Под воздействием наполнения мышц кровью, гликогеновое депо растягивается, увеличивается размер клеток, которые могут хранить его.
- Гликоген поступает в кровь только до тех пор, пока пульс не пересечет отметку в 80% от максимального ЧСС. В случае превышения этого порога, недостаток кислорода приводит к стремительному окислению жирных кислот. На этом принципе основана «сушка организма».
- Гликоген не влияет на силовые показатели – только на выносливость.
Интересный факт: в углеводное окно можно безболезненно употреблять любое количество сладкого и вредного, так как организм в первую очередь восстанавливает гликогеновое депо.
Взаимосвязь гликогена и спортивных результатов предельно проста. Чем больше повторений – больше истощения, больше гликогена в дальнейшем, а значит, больше повторений в итоге.
Увы, но накопление гликогена не способствует похудению. Тем не менее, не стоит бросать тренировки и переходить на диеты. Рассмотрим ситуацию подробнее. Регулярные тренировки приводят к увеличению гликогенового депо. Суммарно за год оно способно увеличится на 300-600%, что выражается в 7-12% повышения общего веса. Да, это те самые килограммы от которых стремятся бежать многие женщины. Но с другой стороны, эти килограммы оседают не на боках, а остаются в мышечных тканях, что приводит к увеличению самих мышц. Например, ягодичных.
В свою очередь, наличие и опустошение гликогенового депо позволяет спортсмену корректировать свой вес в короткие сроки. Например, если нужно похудеть на дополнительные 5-7 килограмм за несколько дней, истощение гликогенового депо серьезными аэробными нагрузками поможет быстро войти в весовую категорию.
Другая важная особенность расщепления и накопления гликогена — перераспределение функций печени. В частности, при увеличенном размере депо избыток калорий связывается в углеводные цепочки без превращения их в жирные кислоты. А что это значит? Все просто – тренированный спортсмен меньше склонен к набору жировой ткани. Так, даже у маститых бодибилдеров, вес которых в межсезонье касается отметок в 140-150 кг, процент жировой прослойки редко достигает 25-27%.
Важно понимать, что не только тренировки влияют на количество гликогена в печени. Этому способствует и основная регуляция гормонов инсулина и глюкагона, которая происходит благодаря потреблению определенного типа пищи. Так, быстрые углеводы при общем насыщении организма скорее всего превратятся в жировую ткань, а медленные углеводы полностью превратятся в энергию, минуя гликогеновые цепочки. Так как же правильно определить, как распределится съеденная пища?
Для этого необходимо учитывать следующие факторы:
- Гликемический индекс. Высокие показатели способствуют росту сахара в крови, который нужно в срочном порядке законсервировать в жиры. Низкие показатели,стимулируют постепенное повышение глюкозы в крови, что способствует полному её расщеплению. И только средние показатели (от 30 до 60) способствуют превращению сахара в гликоген.
- Гликемическая нагрузка. Зависимость обратно пропорциональная. Чем ниже нагрузка, тем больше шансов превращения углеводов в гликоген.
- Тип самого углевода. Всё зависит от того, насколько просто углеводное соединение расщепляется на простые моносахариды. Так, например мальтодекстрин с большей вероятностью превратится в гликоген, хотя имеет высокий гликемический индекс. Этот полисахарид попадает напрямую в печень, минуя пищеварительный процесс, и в этом случае его проще расщепить на гликоген, чем превратить в глюкозу и снова пересобрать молекулу.
- Количество углеводов. Если правильно дозировать количество углеводов в один прием пищи, то даже питаясь шоколадками и кексами вам удастся избежать жирового отложения.
Итак, углеводы неравноценны по своей способности превращения в гликоген или в жирные полинасыщенные кислоты. Во что превратится поступающая глюкоза, зависит только от того, в каком количестве она выделится при расщеплении продукта. Так, например, очень медленные углеводы с большой вероятностью вообще не превратятся ни в жирные кислоты, ни в гликоген. В то же время чистый сахар уйдет в жировую прослойку практически целиком.
Примечание редакции: приведённый ниже список продуктов нельзя рассматривать как истину в последней инстанции. Метаболические процессы зависят от индивидуальных особенностей конкретно взятого человека. Мы указываем лишь процентную вероятность, что этот продукт будет более полезным или более вредным для вас.
| Наименование | Гликемический индекс | Процент вероятности полного сжигания | Процент вероятности превращения в жир | Процент вероятности превращения в гликоген |
| Финики сушёные | 204 | 3.7% | 62.4% | Итог |
Гликоген в мышцах и печени особенно важен для атлетов, практикующих кроссфит. Механизмы накопления гликогена предполагают стабильное увеличение базового веса. Тренировка энергетических систем поможет не только достичь высоких спортивных результатов, но и увеличит общий запас дневной энергии. Вы будете меньше уставать и лучше себя чувствовать.
Для спортсмена наращивание гликогеновых запасов — не только необходимость, но и профилактика ожирения. Сложные углеводы могут храниться в мышцах сколь угодно долго, не окисляясь и не распадаясь. При этом любая нагрузка приводит к их растрате и регуляции общего состояния организма.
И напоследок один интересный факт: именно распад гликогена ведет к тому, что большая часть глюкозы попадает через кровь напрямую в ЦНС, стимулируя выброс эндорфинов и улучшая мозговую деятельность.
источник
Включение глюкозы в метаболизм начинается с образования фосфоэфира — глюкозо-6-фосфата. В клетках мышц и других органах эту реакцию катализирует фермент гексокиназа, его Км менее 0,1 ммоль/л. В клетках печени эту же реакцию катализирует глюкокиназа, значение Км которой примерно 10 ммоль/л. Это значит, что насыщение глюкокиназы происходит только при высокой концентрации глюкозы. Различия в свойствах ферментов объясняют, почему в период пищеварения глюкоза задерживается в основном в печени. Глюкокиназа при высокой концентрации глюкозы в этот период максимально активна. Напротив, гексокиназа, обладая большим сродством к глюкозе, способна выхватывать ее из общего кровотока, где концентрация глюкозы ниже.
 Обмен гликогена в печени и мышцах Обмен гликогена в печени и мышцах |
Физиологическое значение гликогенолиза в печени и в мышцах различно. Мышечный гликоген является источником глюкозы для самой клетки. Гликоген печени используется главным образом для поддержания физиологической концентрации глюкозы в крови. Различия обусловлены тем, что в клетке печени присутствует фермент глюкозо-6-фосфатаза, катализирующая отщепление фосфатной группы и образование свободной глюкозы, после чего глюкоза поступает в кровоток. В клетках мышц нет этого фермента, и распад гликогена идет только до образования глюкозо-6-фосфата, который затем используется в клетке.
Дата добавления: 2015-07-13 ; Просмотров: 223 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Расщепление и синтез гликогена осуществляют различные ферменты.
Расщепление гликогена с образованием глюкозо-1-фосфата катализирует гликоген-фосфорилаза (рис. 5). А синтез гликогена происходит при участии других ферментов.
Основные этапы синтеза гликогена следующие.
1. На первом этапе из свободной глюкозы образуется глюкозо-6-фосфат:
АТФ + Глюкоза > Глюкозо-6-фосфат + АДФ
2. Затем из глюкозо-6-фосфата образуется глюкозо-1-фосфат. Эта реакция обратима.
3. Следующий этап является ключевым. В реакции катализируемой глюкозо-1-фосфат-уридилтрансферазой образуется уридилдифосфатглюкоза (UDP-глюкоза):
UТP + Глюкозо-1-фосфат > UDP-глюкоза + РРi.
4. Далее гликоген-синтаза катализирует перенос гликозильных групп от UDP-глюкозы на молекулу гликогена с образованием альфа(1-4)-связи.
5. Образование боковой цепи гликогена катализирует «ветвящий» фермент гликозил-(4-6)-трансфераза.
В организме человека, как и животных, гликоген синтезируется практически во всех тканях, но больше всего в печени и скелетных мышцах.
Регуляция расщепления и синтеза гликогена также взаимосвязана
Также как гликолиз и глюконеогенез, расщепление и синтез гликогена регулируются взаимосвязано.
Если гликоген-фосфорилаза активируется, то гликоген-синтаза ингибируется, и наоборот.
Регуляцию этих ферментов в печени в конечном счете осуществляют гормоны: инсулин и контринсулярные гормоны, например, адреналин и глюкагон. Инсулин ингибирует распад и стимулирует синтез гликогена.
Контринсулярные гормоны стимулируют расщепление гликогена. Некоторые контринсулярные гормоны проявляют селективность по отношению к различным органам и тканям. Например, глюкагон стимулирует расщепление гликогена только в печени, но не в скелетных мышцах.
Гликогенозы. Ряд наследственных болезней связан с нарушением обмена гликогена. Эти болезни получили название гликогенозов. Они возникают в связи с дефицитом или полным отсутствием ферментов, катализирующих процессы распада или синтеза гликогена, и характеризуются избыточным его накоплением в различных органах и тканях (табл. 10.2).
Гликогеноз I типа (болезнь Гирке) встречается наиболее часто, обусловлен наследственным дефектом синтеза фермента глюкозо-6-фосфатазы впечени и почках. Болезнь наследуется по аутосомно-рецессивному типу. Патологические симптомы появляются уже на первом году жизни ребенка: увеличена печень, нередко увеличены почки. В результате гипогликемии появляются судороги, задержка роста, возможен ацидоз. В крови – повышенное количество лактата и пирувата. Введение адреналина или глюка-гона вызывает значительную гиперлактатацидемию, но негипергликемию, так как глюкозо-6-фосфатаза в печени отсутствует и образования свободной глюкозы не происходит.
57. Регуляция обмена углеводов и поддержания физиологического уровня глюкозы в крови. Характеристика гормонов и механизм их действия. Гипо- и гипергликемии.
. Гормоны. К гормонам, которые влияют на углеводный обмен, принадлежат пептиды инсулин иглюкагон, глюкокортикоид кортизол и катехоламин адреналин (см. сс. 362, 368). Инсулининдуцирует (см. с. 120) синтез de novo гликоген-синтазы [1], а также некоторых ферментов гликолиза [3, 5, 7]. Одновременно инсулин подавляет синтез ключевых ферментов глюконеогенеза (репрессия,[4, 6, 8, 9]). Глюкагон как антагонист инсулина действует в противоположном направлении: индуцирует ферменты глюконеогенеза [4, 6, 8, 9] и репрессирует пируваткиназу [7], ключевой фермент гликолиза. Другие аффекты глюкагона основаны на взаимопревращении ферментов и опосредованы вторичным мессенджером цАМФ (сАМР, см. с. 114). По этому механизму тормозится синтез гликогена [1] и активируется расщепление гликогена [2]. Подобным образом действует и адреналин. Торможение пируваткиназы [7] глюкагоном также обусловлено взаимопревращением ферментов.
Глюкокортикоиды, прежде всего кортизол (см. с. 362), индуцируют все ключевые ферменты глюконеогенеза [4, 6, 8, 9]. Одновременно они индуцируют ферменты деградации аминокислот и обеспечивают тем самым глюконеогенез исходными соединениями.
Метаболиты. Высокие концентрации АТФ (АТР) и цитрата тормозят гликолиз путем аллостерической регуляции фосфофруктокиназы. Кроме того, АТФ тормозит пируваткиназу. Ингибитором пируваткиназы является ацетил-КоА. Все эти метаболиты образуются при распаде глюкозы (торможение конечным продуктом). АМФ (AMP), сигнал дефицита АТФ, активирует расщепление гликогена и тормозит глюконеогенез.
Гипогликемия. Нередко гипогликемия связана с понижением функций тех эндокринных желез, повышение функций которых приводит, как отмечалось, к гипергликемии. В частности, гипогликемию можно наблюдать при гипофизарной кахексии, аддисоновой болезни, гипотиреозе. Резкое снижение уровня глюкозы в крови отмечается при аденомах поджелудочной железы вследствие повышенной продукции инсулина β-клетками панкреатических островков. Кроме того, гипогликемия может быть вызвана голоданием, продолжительной физической работой, приемом β-ганглиоблока-торов. Низкий уровень глюкозы в крови иногда отмечается при беременности, лактации.
Гипогликемия может возникнуть при введении больным сахарным диабетом больших доз инсулина. Как правило, она сопровождает почечную глюкозурию, возникающую вследствие снижения «почечного порога» для глюкозы.
58. Особенности обмена глюкозы в различных тканях (мышцы, эритроциты, мозг, жировая ткань, печень). Зависимость путей использования глюкоза от ритма и характера питания.
ОСОБЕННОСТИ И ЗНАЧЕНИЕ ГЛИКОЛИЗА В ЭРИТРОЦИТАХ 1. Генерация АТФ. АТФ используется для 1) активного транспорта катионов через мембрану, 2) сохранения целостности мембраны и формы эритроцитов. 2. В процессе гликолиза генерируется НАДН2, который является: 1) кофактором метгемоглобинредуктазы — фермента, катализирующего переход мет-Hb в Hb; этот процесс предотвращает накопление мет-Hb (кофактором может являться и НАДФН2); 2) кофактором ЛДГ (лактатдегидрогеназы); 3) поставщиком протонов для супероксиддисмутазной реакции. 3. В процессе гликолиза 1,3-дифосфоглицерат (1,3-ДФГ) превращается в 2,3-ДФГ. На этот процесс расходуется 20-25% глюкозы. 2,3-ДФГ — активная отрицательно заряженная молекула. В эритроцитах периферической крови образует солевую связь с Hb, уменьшает его сродство к кислороду, что обеспечивает переход кислорода в клетки тканей. В капиллярах легких Hb освобождается от 2,3-ДФГ и приобретает способность акцептировать кислород. ПФП — ГЛАВНОЕ НАЗНАЧЕНИЕ — генерация восстановленного кофактора НАДФН2, который используется в эритроцитах для восстановления глутатиона при участии глутатионредуктазы, поставляет протоны для супероксидодисмутазной реакции, хотя и слабо, но используется мет-Hb-редуктазой для восстановления мет-Hb в Hb. Промежуточный продукт ПФП — 3-ФГА (3-фосфоглицериновый альдегид) используется в процессе гликолиза, в том числе и для синтеза 2,3-ДФГ.
Глюкоза высвобождается из печени в промежутках между приемами пищи. Если уровень глюкозы в крови начинает снижаться до нижнего предела в промежутках между приемами пищи, это приведен к ряду изменений и послужит поводом для высвобождения глюкозы из печени в кровоток. 1. Снижение уровня глюкозы приводит к снижению секреции инсулина поджелудочной железой.
2. Отсутствие инсулина приведет к изменению направления реакций, нацеленных на создание запаса гликогена, главным образом к остановке дальнейшего синтеза гликогена в печени и предупреждению поступления глюкозы в печень из крови.
3. Отсутствие инсулина (параллельно с увеличением глюкагона, что будет рассмотрено далее) активирует фермент фосфорилазу, расщепляющую гликоген до глюкозофосфата.
4. Фермент глюкофосфатаза, ингибируемый инсулином, при отсутствии инсулина активируется и приводит к отщеплению фосфатного радикала от глюкозы, что позволяет свободной глюкозе вернуться в кровь.
Таким образом, печень забирает глюкозу из крови, когда в крови возникает ее избыток в связи с приемом пищи, и возвращает ее в кровь, когда концентрация глюкозы снижается в промежутках между приемами пищи. Обычно около 60% глюкозы пищи запасается таким способом в печени и в последующем возвращается в кровь. Инсулин обеспечивает превращение избытка глюкозы в жирные кислоты и ингибирует глюконеогенез в печени.
Цель мышечной клетки – наиболее эффективно использовать поступающую глюкозу для образования АТФ, необходимого для осуществления механической работы – сокращения. В состоянии покоя значительные количества глюкозы резервируются в форме гликогена. Цитоплазма мышечных клеток содержит в высоких концентрациях ферменты гликолиза, а изобилие митохондрий обеспечивает эффективный распад продуктов гликолиза через путь лимонной кислоты и цепь переноса электронов. Лишь в условиях крайнего утомления эти аэробные процессы е справляются с накоплением лактата.
В мышцах идет гликогенез, мышца осуществляет лишь немногие синтетические функции. Ключевые ферменты глюконеогенеза в мышцах отсутствуют, и глюконеогенез не идет. Для востановительных синтезов в мышце НАДФ . Н не требуется, и фосфоглюконатный путь почти не функционирует.
Обмен углеводов в мышцах обеспечивает создание тканевых запасов гликогена в состоянии покоя и использование этих запасов, а также поступающей глюкозы при напряженной работе; основные энергетические потребности всех типов мышц удовлетворяются главным образом за счет окисления продуктов обмена жиров. Ни медленно сокращающаяся гладкая мышечная ткань, ни сердечная мышца не потребляют глюкозу в значительной мере. Во время напряженной работы сердце обеспечивает себя лактатом для окисления.
источник
Биосинтез гликогена в печени и мышцах: последовательность и химизм реакций, характеристика ферментов и продуктов. Регуляция обмена гликогена.
Гликоген способен синтезироваться почти во всех тканях, но наибольшие запасы гликогена находятся в печени и скелетных мышцах.
Накопление гликогена в мышцах отмечается в период восстановления после работы, особенно при приеме богатой углеводами пищи.
В печени гликоген накапливается только после еды, при гипергликемии. Такие отличия печени и мышц обусловлены наличием различных изоферментов гексокиназы, фосфорилирующей глюкозу в глюкозо-6-фосфат. Для печени характерен изофермент (гексокиназа IV), получивший собственное название – глюкокиназа. Отличиями этого фермента от других гексокиназ являются:
— низкое сродство к глюкозе, что ведет к захвату глюкозы печенью только при ее высокой концентрации в крови, продукт реакции (глюкозо-6-фосфат) не ингибирует фермент, в то время как в других тканях гексокиназа чувствительна к такому влиянию. Это позволяет гепатоциту в единицу времени захватывать глюкозы больше, чем он может сразу же утилизовать.
Благодаря особенностям глюкокиназы гепатоцит эффективно захватывает глюкозу после еды и впоследствии метаболизирует ее в любом направлении. При нормальных концентрациях глюкозы в крови ее захват печенью не производится.
Непосредственно синтез гликогена осуществляют следующие ферменты:
— Фосфоглюкомутаза – превращает глюкозо-6-фосфат в глюкозо-1-фосфат;


Регулирование: — Два гормона — адреналин и глюкагон — могут активировать фосфорилазу и таким образом ускорять процессы гликогенолиза. Начальные моменты влияний этих гормонов связаны с образованием в клетках циклического аденозинмонофосфатау который затем запускает каскад химических реакций, активирующих фосфорилазу.
— Адреналин выделяется из мозгового вещества надпочечников под влиянием активации симпатической нервной системы, поэтому одна из ее функций заключается в обеспечении обменных процессов. Эффект адреналина особенно заметен в отношении клеток печени и скелетных мышц, что обеспечивает наряду с влияниями симпатической нервной системы готовность организма к действию.
— Глюкагон — гормон, выделяемый альфа-клетками поджелудочной железы, когда концентрация глюкозы в крови снижается до слишком низких значений. Он стимулирует образование циклического АМФ главным образом в клетках печени, что, в свою очередь, обеспечивает превращение в печени гликогена в глюкозу и ее высвобождение в кровь, повышая таким образом концентрацию глюкозы в крови.
2. 
Реакция гликолитической оксидоредуктации= 6 реакции гликолиза превращение из ГАФ — 1,3 дифосфоглицерата.
Химизм: В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы НАД (НАДН). Эта реакция блокируется йод- или бромацетатом.

В анаэробных условиях, образовавшийся НАДН2 идет в реакцию образования из ПВК – молочной кислоты.
3. Охарактеризуйте цАМФ как посредник между гормонами и ферментами. Назовите гормоны и контролируемые ими ферменты, повышающие и снижающие содержание цАМФ. Как изменяется содержание глюкозы в крови под влиянием этих гормонов?
Циклический аденозинмонофосфат (цAMФ) — производное АТФ, выполняющее в организме роль вторичного посредника, использующегося для внутриклеточного распространения сигналов некоторых, которые не могут проходить через клеточную мембрану.
цAMФ осуществляет функции вторичного внутриклеточного посредника в действии первичных посредников — например, ряда гормонов и нейромедиаторов. цAMФ опосредует биологическую функцию гормонов путем активации (инактивации) клеточных протеинкиназ (фосфатаз). Протеинкиназы, в свою очередь, фосфорилируют эффекторные белки и изменяют (увеличивают или уменьшают) их активность.
При активации аденилатциклазы, катализирующей образование цAMФ из АТФ, или блокировании фосфодиэстеразы, осуществляющей деградацию этого цAMФ, концентрация цAMФ в клетке увеличивается. Таким образом, содержание цAMФ в клетке определяется соотношением активностей этих двух ферментов. Связь между гормоном или др. химическим сигналом (первый посредник) и цAMФ (второй посредник) осуществляет аденилатциклазный комплекс, включающий рецептор, настроенный на определённый гормон (или др. биологически активное вещество) и расположенный на внешней стороне клеточной мембраны, и аденилатциклазу, расположенную на внутренней стороне мембраны. Гормон, взаимодействуя с рецептором, активирует аденилатциклазу, которая образует цAMФ из АТФ.
— Инсулин – понижает концентрацию глюкозы в крови;
— Адреналин – вызывает резкое увеличение глюкозы в крови;
— Глюкагон и Кортизол– повышают уровень глюкозы в крови.
Последнее изменение этой страницы: 2016-04-06; Нарушение авторского права страницы
источник


