Какие химиопрепараты помогают при раке печени? Как проводят лечение? Что такое химиоэмболизация? Применяют ли при злокачественных опухолях печени таргетную терапию и иммунопрепараты?
Химиотерапия — один из основных методов лечения (два других — хирургия и лучевая терапия) онкологических заболеваний. Химиопрепараты повреждают раковые клетки таким образом, что те больше не могут размножаться и погибают.
Разные опухоли отвечают на химиотерапию по-разному. Одни поддаются лечению хорошо, другие практически не реагируют на него. Рак печени относится ко второй категории. Для системной химиотерапии (такой, когда препарат вводят внутривенно или принимают в виде таблеток) можно использовать лишь немногие химиопрепараты: цисплатин, 5-фторурацил, адриамицин (доксорубицин), но и они эффективны далеко не у всех пациентов, опухоли печени быстро вырабатывают по отношению к ним устойчивость.
Однако, при раке печени могут быть эффективны некоторые методы местной химиотерапии.
Местной называют такую химиотерапию, при которой препарат вводят непосредственно в опухолевую ткань, в общий кровоток он практически не попадает. Для этого прибегают к специальным процедурам. При раке печени применяют интраартериальную химиотерапию и химиоэмболизацию.
Одна из функций печени состоит в том, что она разрушает токсичные вещества. С этим связана главная проблема химиотерапии при раке печени. Химиопрепараты не успевают достичь опухолевой ткани и оказать свои эффекты, так как их захватывают и разрушают печеночные клетки — гепатоциты. Решением могло бы стать увеличение дозировок, но при системной химиотерапии это приводит к тяжелым побочным эффектам.
При интраартериальной химиотерапии препарат вводят непосредственно в печеночную артерию. Он попадает только в печеночную ткань и не разносится по всему организму. Благодаря этому можно сильно увеличить дозу, не боясь нежелательных эффектов.
Чаще всего для интраартериальной химиотерапии при раке печени применяют такие препараты, как доксорубицин, митомицин С, цисплатин, флоксуридин.
Данный вид местной химиотерапии показывает достаточно высокую эффективность, но и он применим не у всех пациентов. Для того чтобы ввести химиопрепарат в печеночную артерию, в нее нужно вставить катетер, а для этого требуется хирургическое вмешательство. Не все больные в состоянии перенести операцию.
Печень — орган, который получает двойное кровоснабжение. Гепатоциты кровоснабжаются из воротной вены. Она собирает кровь от кишечника и несет в печень вещества, которые всасываются в пищеварительном тракте. Раковые клетки кровоснабжаются из печеночной артерии. Логична идея каким-либо образом заблокировать кровоток в печеночной артерии. Благодаря этому раковые клетки перестали бы получать кровь, кислород и питательные вещества. При этом гепатоциты продолжили бы кровоснабжаться, как прежде.
И такой метод существует. Называется он эмболизацией. В печеночную артерию вводят через катетер специальный эмболизирующий препарат, который содержит микросферы. Они перекрывают просвет сосудов. Модификация метода — химиоэмболизация, когда микросферы несут химиопрепарат. Таким образом, опухолевые клетки получают двойной удар.
Химиоэмболизацию проводят с помощью специального катетера, который вводят в бедренную артерию через надрез в паху. В сосуды вводят рентгеноконтрастный раствор, катетер под контролем рентгена проводят в печеночную артерию, и как только его кончик оказывается в нужном месте, вводят препарат.
Однако, и здесь не все так просто. Если заблокировать кровоток в печеночной артерии, часть здоровой ткани печени все же лишится притока крови. Из-за этого процедура может быть проведена не у всех пациентов.
Нормальные клетки становятся раковыми из-за изменений в их генах. Генетические нарушения приводят к тому, что некоторые молекулы начинают работать неправильно, они помогают опухолевым клеткам становиться бессмертными и бесконтрольно размножаться. С развитием молекулярной биологии и молекулярной генетики ученые смогли идентифицировать многие из этих веществ и понять, как их можно заблокировать. Это привело к созданию нового класса лекарств — таргетных препаратов.
При раке печени применяют следующие таргетные препараты:
- Сорафениб блокирует рост новых сосудов, которые опухоль «выращивает», чтобы обеспечить себя кислородом и питательными веществами. Также он блокирует белки-рецепторы на поверхности раковых клеток, которые активируют их размножение. Препарат принимают в виде таблеток 2 раза в день.
- Регорафениб работает похожим образом. Обычно его назначают, если неэффективен сорафениб. Препарат принимают в таблетках 1 раз в день в течение 3 недель, после чего делают перерыв.
За счет прицельного воздействия на опухолевые клетки, таргетные препараты вызывают меньше побочных эффектов по сравнению с химиопрепаратами.
Несколько десятилетий назад ученые выдвинули концепцию, согласно которой в ДНК клеток организма регулярно возникают поломки, и некоторые из них могут превратить клетку в раковую, поэтому должны работать естественные механизмы защиты. Основным из них был назван иммунитет.
Иммунная система устроена очень сложно. В ней постоянно присутствует тонкое равновесие: иммунитет должен эффективно реагировать на чужеродные агенты, включая антигены раковых клеток, но не должен быть агрессивен настолько, чтобы повреждать здоровые ткани. Для сдерживания чрезмерной иммунной агрессии предназначены особые вещества — контрольные точки. Однако, злокачественные опухоли используют их для того, чтобы избежать иммунной атаки.
Контрольные точки можно заблокировать искусственно. Для этого учеными созданы специальные иммунопрепараты — они называются ингибиторами контрольных точек.
При раке печени применяется препарат ниволумаб (коммерческое название — Опдиво). Он блокирует белок PD1 на поверхности T-лимфоцитов, который мешает их активации. В итоге иммунные клетки снова начинают атаковать опухолевую ткань. Вводят препарат внутривенно, обычно раз в две недели. Ниволумаб нередко назначают пациентам с раком печени, которые ранее получали лечение таргетными препаратами.
источник
Чем можно помочь пациенту при раке четвертой стадии? Может быть врачи ошиблись, и рак не 4-й, а 3-й стадии? Каков прогноз при последней стадии рака? Излечим ли рак на 4-й стадии? Что можно сделать, чтобы облегчить состояние при раке 4 стадии? Сколько проживет мой близкий с раком на четвертой стадии?
Чтобы облегчить общее состояние пациента на поздних стадиях рака, используются основные методы поддержания жизненно важных функций, включая интенсифицированную внутривенную терапию, плазмаферез, гемосорбцию, переливание крови и кровекомпонентов.
В отделении интервенционной онкологии мы проводим такие паллиативные и вспомогательные операции, как:
- имплантация венозных и артериальных инфузионных порт-систем для химиотерапии;
- наложение нефростом при поражении почек;
- дренирование и стентирование желчных протоков при механической желтухе опухолевого генеза;
- установка кава-фильтров в нижнюю полую вену с целью профилактики тромбоэмболии;
- стентирование верхней полой вены при её обструкции опухолевого генеза и ряд других.
На четвертой стадии рака важна современная обезболивающая терапия.
Четвёртая стадия рака – это необратимый бесконтрольный процесс разрастания и распространения опухолевых клеток по организму, при котором происходит повреждение соседних здоровых органов и тканей, формирование отдаленных (метастатических) очагов опухоли в далеко расположенных органах. При раке четвёртой стадии первичный очаг может быть любых размеров: от 5-6 мм при нейроэндокринной опухоли желудочно-кишечного тракта или меланоме и до 10-30 см в диаметре при опухоли Юинга.
Критерии постановки диагноза четвертой стадии онкологического заболевания включают:
- прогрессирующее поражение раком с распространением в кости, лёгкие, печень, поджелудочную железу и (или) в мозг, или
- быстрорастущие раковые образования (быстрорастущая опухоль), или
- любой тип рака кости, или
- чрезвычайно-фатальные раковые образования (например, рак легкого, панкреатический рак, многократная миелома, squamous cell carcinoma, меланома и т.д.)
Стадия рака показывает, насколько сильно злокачественная опухоль проросла в соседние ткани, успела ли дать метастазы в лимфатические узлы и в различные части тела. Это очень важная информация, потому что она помогает врачу разработать оптимальную тактику лечения, выстроить достоверный прогноз.
Чтобы определить стадию рака, врачи опираются на общепринятую TNM-классификацию. Буква T обозначает размер и локализацию первичной опухоли, N — метастазы в близлежащих лимфатических узлах, M — отдаленные метастазы. Возле каждой буквы указывают числовой индекс.
Комбинации различных значений T, N и M объединяют в четыре стадии (есть еще дополнительная — нулевая):
- Стадия 0. Опухоль находится в пределах тканей, из которых развилась, и не прорастает в соседние структуры. Новообразование можно полностью удалить хирургическим путем;
- Стадия I. Опухоль относительно небольшая и не успела глубоко прорасти в окружающие ткани;
- Стадия II. Опухоль по-прежнему не распространяется в соседние ткани, но больше по размерам. Могут обнаруживаться единичные метастазы в близлежащих лимфатических узлах;
- Стадия III. Раковые клетки распространились в окружающие ткани и ближайшие лимфатические узлы;
- Стадия IV. Метастатический рак: опухолевые клетки распространились в разные части тела.
Иногда к цифрам приписывают латинские буквы — А, В, С, если в стадии нужно выделить подстадию.
Пока рак не достиг IV стадии, больной человек может не испытывать никаких симптомов. Это одна из главных причин поздней диагностики онкологических заболеваний. Если опухоль обнаружена на ранней стадии, как правило, это произошло случайно, или благодаря регулярному скринингу.
Симптоматика рака IV стадии зависит от типа и размеров опухоли, наличия метастазов, степени прорастания раковых клеток в различные ткани и органы.
Среди общих симптомов можно выделить следующие:
- повышенная утомляемость, постоянное чувство усталости;
- снижение аппетита;
- одышка;
- потеря веса, вплоть до истощения — кахексии;
- тошнота и рвота;
- желтуха.
Метастазы в кости приводят к болям в конечностях и патологическим переломам; в головной мозг – к головным болям, головокружениям, судорогам; в легкие – к одышке; в печень – к увеличению живота и желтухе.
У некоторых пациентов развивается паранеопластический синдром — реакция на опухоль и биологически активные вещества, которые она выделяет. Он проявляется разными симптомами — со стороны кожи, эндокринной, нервной, сердечно-сосудистой, пищеварительной систем, опорно-двигательного аппарата, крови.
Лечение четвертой стадии рака любой локализации при обширном опухолевом поражении и наличии отдаленных метастазов носит преимущественно паллиативный и симптоматический характер. Основные задачи врача в лечении таких пациентов следующие:
- Ограничение распространенности опухоли.
- Уменьшение темпов роста опухоли, задержка прогрессирования опухолевого процесса.
- Сохранение функционирования органов и систем.
- Профилактика угрожающих жизни осложнений – тромбоэмболии, инсультов, инфарктов.
Основные методы лечения рака 4-й стадии включают в себя паллиативные хирургические операции, химиотерапию, лучевую терапию, гормонотерапию, иммунотерапию и другие методы, используемые изолированно и совместно, в зависимости от типа злокачественной опухоли.
Совершенствование методов лечения онкологических заболеваний на поздних стадиях привело к внедрению процедур, позволяющих существенно улучшить качество жизни пациентов, а также продлить жизнь до года и более. При этом часть пациентов сохраняет трудоспособность и возможность общения с родными и близкими.
Новые методы лечения онкологических заболеваний отличаются эффективностью и минимальными побочными эффектами и включают:
Индивидуальные противоопухолевые вакцины готовят параллельно с хирургическим вмешательством, при котором удаляют большой объём опухоли. Из удалённой опухоли выращивают клеточную культуру, а из лейкоцитов крови пациента выделяют лимфатические дендритные клетки. В специальных лабораторных условиях иммунные клетки обучают реагировать на антигены удалённой опухоли. В результате получается индивидуальная вакцина от рака, которая дополнительно защищает пациента от рецидивов и метастазирования.
Моноклональные антитела , в том числе препараты типа имутерана, Erlotinib, назначаемого при раке толстой кишки, препарата SU11248, применяемый при лечении рака желудка, избирательно воздействуют на злокачественные клетки и вызывают их изолированную гибель после внутривенного введения. В лечении меланомы используют препараты Опдиво, Китруду, Тафинлар.
Радиоэмболизация метастазов печени проводится при различных онкологических заболеваниях на поздних стадиях. Включает в себя проводимую под контролем ангиографа внутрисосудистую селективную катеризацию сосудов печени и введение эмболизирующих частиц с радиоактивным изотопом иттрий-90. Изотопы сохраняют активность и борются с опухолевыми клетками в течение 64 часов.
Химиоэмболизация микросферами – эндоваскулярная операция, во время которой непосредственно в артерию, питающую метастаз, вводят микросферы с иммобилизованными химиопрепаратами. Химиоэмболизация проводится при неоперабельных новообразованиях, при выраженном объёмном поражении печени, тяжёлых сопутствующих соматических заболеваниях. Применение цифровых рентгеновских хирургических аппаратов, высокотехнологичных внутрисосудистых инструментов позволяет проводить данную операцию неоднократно без побочных эффектов и осложнений. Методика химиоэмболизации может комбинироваться с другими методами лечения опухолей.
Радиочастотная RF-аблация опухолей печени проводится при первичных опухолях печени и при метастатическом поражении печени диаметром до 5 см. Является мировым стандартом в комплексном лечении поздних стадий и метастазов колоректального рака.
РЧА противопоказана при расположении опухолевого очага в непосредственной близости к портальной вене, желчному пузырю, крупным жёлчным протокам.
- При чрескожной чреспеченочной радиочастотной RF-аблации под ультразвуковым контролем и общим обезболиванием сквозь кожу и паренхиму печени вводят полую иглу, через которую затем вводится монополярный радиоволновой электрод.
- Электрод локально разогревает участок паренхимы печени, вызывая коагуляцию тканей опухоли и локальный некроз.
- В ряде случаев радиочастотная RF-аблация опухолей печени выполняется во время лапаротомии, во время ликвидации кишечной непроходимости с наложением анастомозов или при удалении опухолевого инфильтрата.
- Выполнение радиочастотной RF-аблации печени существенно расширяет показания к хирургическому лечению пациентов с множественным полисегментарным поражением печени.
В целом, даже паллиативное и симптоматическое лечение рака 4 стадии любой локализации продлевает жизнь пациента и улучшает её качество.
Ключевой показатель прогноза при четвертой стадии рака — пятилетняя выживаемость, процент пациентов, которые продолжают жить по истечении 5-ти лет от момента постановки диагноза 4-й стадии рака.
На ранних стадиях рака пятилетняя выживаемость наиболее высока и в некоторых случаях приближается к 100%. На 4 стадии она наиболее низкая, но это не означает, что шансов нет совсем. Показатель пятилетней выживаемости носит статистический характер. Его рассчитывают, исходя из наблюдения за большим количеством больных. Но каждый пациент уникален. Нужно делать поправку на возраст, сопутствующие заболевания, общее состояние здоровья.
Кроме того, показатели пятилетней выживаемости рассчитывают на основании наблюдения за пациентами, у которых рак был диагностирован, как минимум, 5 лет назад. С тех пор появились новые препараты, изменились подходы к лечению. У современных онкобольных есть повод рассчитывать на несколько лучшие прогнозы.
Наиболее точный прогноз для вас сможет дать только ваш лечащий врач. Даже если выживаемость при данном типе рака очень низкая, и прогноз, скорее всего, неблагоприятен, врач всегда может назначить поддерживающее лечение, которое поможет продлить жизнь и избавит от мучительных симптомов.
В Японии, США, Германии, Швейцарии, Израиле и ряде других стран, терминальная стадия рака диагностируется гораздо реже, чем в России. Это связано с особенностями организации медицинского обслуживания. Граждане этих стран с детства знают о преимуществах профилактики перед лечением.
В России диагностированный рак на 4-й стадии встречается нередко, а выживаемость при таком диагнозе составляет от полугода до двух с половиной лет. Для сравнения, в Германии и США прогноз выживаемости составляет не менее 5 лет. Такая же статистика и в Европейской клинике, причем, на счету нашей клиники есть несколько случаев дестадирования. В чем причина такой разницы?
Во-первых, как уже отмечалось – разные принципы организации медицинской помощи. К сожалению, Минздрав, до недавнего времени не обозначал предельных сроков начала лечения обнаруженного рака. Больные могли ждать начала терапии по нескольку месяцев, что, конечно, пагубно сказывается на прогнозах.
Во-вторых – лекарства, их цена и качество. Практически все по-настоящему эффективные препараты производятся в Европе или США. Большинство из них очень дороги и приобрести их могут далеко не все. Аналоги, имеющиеся в России, как правило сильно уступают в качестве зарубежным.
В-третьих – протоколы лечения. Существуют международные предписания по лечению того или иного вида опухоли, которые постоянно пополняются и совершенствуется. Однако, в России по большей части лечат по собственным протоколам, многие из которых устарели и показывают куда меньшую эффективность по сравнению с зарубежными.
В Европейской клинике знают, как помочь и добиться наилучшего прогноза:
- Организация оказания медицинской помощи построена по «золотому стандарту» клиник США и Европы.
- Используются препараты зарубежного производства, доказавшие свою эффективность. Подлинность проверяется на каждом этапе от закупки у официального представительства фирмы-производителя до доставки препарата.
- Специалисты клиники руководствуются международными протоколами лечения.
- Мы умеем лечить рак, и делаем это так же, как лучшие клиники мира.
При раке лёгких 4-й стадии средний показатель пятилетней выживаемости в среднем составляет около 10%. При мелкоклеточном раке легких этот показатель составляет около 1 %, а при немелкоклеточном раке легких выживаемость существенно выше и варьирует от 2 до 13%, в зависимости от степени метастазирования в другие органы и ткани, а также поражения плевры и перикарда. Если ранее пациенту была выполнена радикальная операция – резекция легкого или его доли — этот показатель существенно выше.
При четвертой стадии рака лёгкого проводится лучевая терапия с целью уменьшения размеров опухоли и облегчения симптомов заболевания. У некоторых пациентов лучевая терапия дополняется курсом химиотерапии, что существенно облегчает общее состояние пациента. При метастатическом поражении плевры и развитии плеврита активно используется торакоцентез для уменьшения объёма жидкости в легких.
При раке печени 4-й стадии прогноз наименее благоприятен – более 5-ти лет проживет только 6% больных. 4-я стадия рака печени характеризуется множественными опухолевыми очагами в обеих долях печени, а также поражением основных ветвей печеночной или портальной вены. Рак печени является быстро прогрессирующим заболеванием, когда между 1 и 4 стадиями рака печени проходит, как правило, 3-4 месяца.
К сожалению, при 4 стадии рака печени классическое химиотерапевтическое лечение малоэффективно. В настоящее время применяются новые медицинские технологии – радиочастотная абляция очагов рака в печени и химиоэмболизация. Ранее проводилось преимущественно обезболивающее лечение для устранения болевого синдрома и лапароцентез для уменьшения асцита и облегчения состояния пациента.
Рак желудка на 4-й стадии имеет наиболее высокий благоприятный прогноз. Показатель 5-летней выживаемости составляет около 15-20%. Более благоприятные результаты отмечены у больных раком кардиальной части желудка, особенно при плоскоклеточном раке желудка после лучевой терапии. Диагноз четвертой стадии рака желудка устанавливается при поражении соседних органов и не менее одного регионарного лимфатического узла, или при поражении желудка и более 15-ти близлежащих лимфатических узлов, или при наличии метастазов в отдаленные органы и ткани. Паллиативная химиотерапия позволяет добиться относительно стойкой стабилизации течения заболевания в 40-45% случаев. Хирургическое лечение при раке желудка на 4 стадии применяется преимущественно для паллиативного лечения жизнеугрожающих состояний – кровотечения из опухоли и других.
При неоперабельном раке проксимального (кардиального) отдела желудка с переходом на пищевод при нарушении прохождения пищи выполняется эндоскопическая установка стента в пищевод и желудок.
Из паллиативных операций при 4-й стадии рака желудка у 10-15% пациентов проводят гастроэнтеростомию с целью восстановления прохождения пищи по желудочно-кишечному тракту, коррекции и профилактики водно-электролитных нарушений. Эта операция показана при неоперабельном раке желудка со стенозом выходного (пилорического отдела) желудка. В отдельных случаях выполняется гастростомия для последующего энтерального питания больного через зонд.
При 4-й стадии рака поджелудочной железы пятилетняя выживаемость пациентов составляет менее 2% при отсутствии лечения и до 10% при проведении активных лечебных мероприятий. Для облегчения состояния пациента применяют комбинацию хирургического вмешательства и химиотерапии.
Наиболее распространенным методом хирургического лечения рака поджелудочной железы является операция Уиппла – панкреатодуоденальная резекция. Операция включает удаление головки поджелудочной железы с опухолью, части двенадцатиперстной кишки, части желудка, жёлчного пузыря, а также ближайших лимфатических узлов. Хирургическое лечение рака не показано, если раковое поражение поджелудочной железы распространилось на крупные прилежащие сосуды или имеются удалённые метастазы.
При сдавлении массивной раковой опухолью жёлчных протоков в области ворот печени и невозможности проведения панкреатодуоденальнальной резекции выполняется чрескожное чреспеченочное дренирование и стентирование жёлчного протока с целью нормализации оттока жёлчи.
Химиотерапевтическое лечение при поздних стадиях рака включает применение таких современных препаратов, как гемцитабин (гемзар), иринотекан (кампто), а также карбоплатина, 5-фторурацила и др.
При четвертой стадии рака кишечника пятилетняя выживаемость составляет менее 5%. Паллиативное хирургическое лечение рака включает восстановление проходимости кишечника при стенозах. В нашей клинике проводятся как операции наложения колостомы, так и стентирование кишечника во время проведения колоноскопии.
При раке молочной железы четвертой стадии пятилетняя выживаемость составляет около 10-15%. Активная терапия рака молочной железы включает хирургическую санацию рака (радикальную мастэктомию), что позволяет избежать массивной интоксикации организма и кровотечения из распадающейся опухоли. При отсутствии существенных нарушений свёртывающей системы крови и декомпенсации функции печени и почек, проведенная химиотерапия рака молочной железы позволяет существенно повысить качество жизни.
Прогноз пятилетней выживаемости при 4 стадии рака предстательной железы составляет около 30%. Основной причиной смерти при раке простаты являются сопутствующие нарушения функции печени, легких, почек. Основные варианты лечения 4-й стадии рака простаты:
- гормональная терапия;
- внешняя лучевая терапия в сочетании с гормональной терапией;
- хирургическая операция: трансуретральная резекция предстательной железы с целью облегчения симптомов онкологического заболевания и профилактики кровотечения из поражённого мочевого пузыря или непроходимости мочевых путей, и, следовательно, развития острой почечной недостаточности.
При раке тела матки на 4 стадии опухолевый процесс распространяется за пределы таза, вовлекая мочевой пузырь, прямую кишку. 5-летняя выживаемость при четвертой стадии рака матки не превышает 3-9%. Лечение таким пациентам назначают индивидуально, в основном оно является комплексным, включающим химиотерапию, гормонотерапию, паллиативное хирургическое лечение.
При 4-й стадии рака шейки матки прогноз пятилетней выживаемости не превышает 8-9%. Переход преинвазивного рака шейки матки в микроинвазивный с последующим быстрым ростом опухоли и переходом в 4-ю стадию может наблюдаться в течение 1-2 лет. Рак шейки матки в настоящее время является одним из быстропрогрессирующих раков. В опухолевый процесс вовлечены все тазовые органы, в том числе влагалище, мочевой пузырь, прямая кишка.
Могли ли ошибиться врачи в поликлинике, выставив сразу диагноз рака на 4-й стадии, если за 2-3 месяца до этого пациент ничем не болел?
Мы наблюдаем устойчивую тенденцию последних десяти лет по росту поздней обращаемости пациентов с онкологическими заболеваниями. Утрата системы регулярной диспансеризации и невнимательность пациентов по отношению к собственному здоровью, игнорирование начальных симптомов со стороны жизненно важных органов (сердца, печени, легких), приводят к тому, что при первичном расширенном диагностическом обследовании по поводу какого-либо недомогания устанавливается диагноз четвертой стадии рака.
Мы встречаем рак шейки матки, развившийся на фоне беременности за 10-12 месяцев из предраковых изменений шейки матки сразу в 4-ю стадию рака. В нашей практике много случаев рака кишечника у мужчин и женщин в возрасте 30-40 лет, которые ранее не обращались к врачу. Во время диагностической колоноскопии по поводу неясных расстройств кишечника у них обнаруживают онкологическое заболевание (рак сигмовидной кишки, рак прямой кишки) на поздней стадии.
Широко распространен миф, что человек с последней стадией рака очень быстро умирает. Однако, правильно подобранная схема лечения позволит продлить жизнь и существенно повысить её качество на срок до 5 лет, в зависимости от вида опухоли и степени поражения жизненно важных органов, а также наличия сопутствующих заболеваний.
Самыми частыми состояниями, существенно ухудшающими качество жизни при четвертой стадии рака, являются:
- нарушение функции печени в результате блокировки желчевыводящих путей и развитие механической желтухи;
- нарушения свертывания крови и развитие тромбоэмболии легочной артерии, пневмонии или инсульта;
- угнетение кроветворной функции костного мозга и развитие анемии, тромбоцитопении и лейкопении;
- патологические переломы позвонков, вызывающие паралич нижних конечностей;
- выраженные боли, особенно сильные при метастазировании в кости;
- артериальный тромбоз с развитием острой ишемии и гангрены нижней конечности и ряд других заболеваний.
При выявлении метастатического поражения костей скелета и позвонков проводится комплексное лечение:
- Противоопухолевая терапия, подавляющая рост опухолевых клеток.
- Лучевая терапия, которая выполняется как для уменьшения болевого синдрома, так и с лечебной целью, вплоть до полного исчезновения одиночных метастазов.
- Радиоизотопное лечение метастазов в кости (с паллиативной целью) для уменьшения боли или с лечебной целью.
- Хирургическое лечение метастазов в кости для предупреждения и лечения переломов.
- Лекарственная терапия костной ткани.
- Эмболизация артерий позвоночника в качестве паллиативной операции, чтобы уменьшить боль и замедлить рост опухоли.
- Радиочастотная аблация (удаление) метастазов в костях и позвоночнике.
- Эпидуральные инъекции при болевых синдромах в позвоночнике, установка помпы.
Лучевая терапия при метастазах в кости скелета в стандартной дозе 15—20 Гр у половины больных приводит к полному исчезновению боли, а при увеличении дозы излучения до 30—40 Гр значительное улучшение состояния наступает у 80—90% пациентов уже в течение первых 2-3 недель.
Лечение метастазов в кости проводится также с помощью радиофармпрепаратов стронция 89Sr и самария 153Sm. Внутривенное введение стронция 89Sr, обладающего высоким сродством к костной ткани, позволяет дать высокую лучевую нагрузку только на костные ткани. Около 10–20 % больных отмечают полное исчезновение боли и примерно 50—60% сообщают о значительном уменьшении выраженности симптомов.
Хирургическое лечение метастазов в кости может проводиться несколькими способами. При наличии значительного количества костного вещества в области патологического перелома длинную трубчатую кость можно стабилизировать с помощью внутрикостного стержня или штифта. Выраженный лизис костного вещества может потребовать укрепления путём заполнения интрамедуллярного канала и кортикальных дефектов трубчатых костей метил-метакрилатным цементом.
При патологических переломах тел позвонков, если ожидаемая продолжительность жизни пациента превышает 3 месяца, проводят открытые или минимально инвазивные операции, например, кифопластику и вертебропластику, которые значительно уменьшают боль и снижают риск компрессии спинного мозга и спинальных нервов.
Лекарственное лечение метастатического поражения костей проводится с помощью бисфосфонатов (Этиндронат, Бонефос, Бондронат, Аредия, Зомета). Препараты этой группы действуют непосредственно на костную ткань и блокируют действие опухолевых клеток на остеокласты, что прекращает разрушение костей остеокластами, уменьшает болевой синдром, предотвращает возникновение патологических переломов, снижает риск развития гиперкальциемии.
Онкология не стоит на месте, и наши возможности в лечении рака постоянно расширяются. В Европейской клинике применяются наиболее современные препараты для лечения онкологических заболеваний, зарегистрированные в России. Это позволяет нам существенно продлевать жизнь онкологических больных и улучшать её качество даже на последней стадии. Узнайте больше — позвоните и запишитесь на консультацию к нашим онкологам.
источник
Рак печени встречается относительно редко и составляет 3-5% от всех случаев злокачественных новообразований. Несмотря на это, смертность от рака печени высокая и связано это в первую очередь с поздней обращаемостью к специалистам. Для рака требуется комплексный подход, состоящий из:
- Хирургического вмешательства,
- Лучевой терапии,
- Химиотерапии.
Хирургическая операция – эффективный метод лечения рака печени. Поэтому в медицине получило название «золотого стандарта». Однако около 80% всех типов рака этого органа не оперируются вследствие метастазирования в отдаленные органы. Такие типы рака называются неоперабельными. И тогда врачи прибегают еще к одному эффективному способу лечения рака – химиотерапии. В данной статье будут разобраны особенности терапии химиопрепаратами рака печени.
За последнее время было создано множество новых химиопрепаратов и схем терапии. Поэтому ее роль и эффективность к настоящему времени значительно возросла.
Суть химиотерапии заключается в оказании химиопрепаратами цитостатического действия, то есть тормозящего рост раковой клетки.
Терапия цитостатиками может проводиться в случаях неоперабельного рака, до или после хирургической операции. Очень редко химиотерапия проводится, как самостоятельный терапевтический метод, чаще – сочетается с другими способами лечения рака.
Выделяют несколько видов химического лекарственного воздействия на клетки рака:
- Системную химиотерапию;
- Локальную химиотерапию;
- Химиоэмболизацию.
Системная химиотерапия – это прием/введение препаратов, тормозящих рост, как раковой клетки, так и клеток всего организма. Химиопрепараты разносятся кровью и оказывают системное действие. От такого действия цитостатиков и возникают все побочные и нежелательные эффекты химиотерапии.
Локальной (регионарной) химиотерапией называется введение химиопрепарата в ткань опухоли. Системные эффекты при данном пути введение менее выражены.
Химиоэмболизация – наиболее эффективный метод лечения рака – осуществляется путем введения цитостатика в печеночную артерию, поставляющую кровь к печени и злокачественному новообразованию. Данный метод получил название ИПА – инфузии в печеночную артерию. Препарат доставляется непосредственно в орган и поэтому системный эффект незначителен.
Лекарственная форма препарата для эмболизации представлена в виде капсулы, геля или масляного раствора, что не только обеспечивает поступление препарата в ткань новообразования, но и нарушает ток крови к раку, его питание и рост.
Для подготовки к химиотерапии достаточно 1 месяца.
Перед началом терапии цитостатиками пациенту необходимо исследование состояния основных органов и систем, и подготовка организма.
В первую очередь врач должен подробно рассказать пациенту о предстоящем лечении и о возможных побочных эффектах. Пациент должен быть проинформирован относительно шансов излечения и психологически быть подготовленным к любому результату. Также больному надо рассказать об особенностях питания и о приеме других препаратов (особенно антибиотиков) в период проведения химиотерапии.
- Лабораторные анализы крови;
- Исследования для оценки работы сердца и сосудов;
- Исследования для оценки работы почек;
- Рентгенологическое исследование костей;
- Другие исследования, необходимые для конкретного пациента.
Для подготовки организма к длительной химиотерапии больному назначаются:
- Инфузионные растворы;
- Гепатопротекторы;
- Препараты против тошноты.
После начала химиотерапии пациенту следует внимательно следить за реакцией своего организма на химиопрепарат. О любом возникшем побочном эффекте, даже малейшем недомогании, необходимо рассказать лечащему доктору.
Химиоэмболизация проводится одномоментно, под общим наркозом в рентген-операционной. Через 2-3 месяца проводят контрольное КТ- или МРТ-исследование для оценки эффективности проведенных мероприятий. При необходимости процедуру повторяют.
Несомненная польза химиотерапии в эффективности метода. Некоторые варианты лечения (ИПА) не длительны и требуют малого количества препаратов. любой вариант терапии химиопрепаратами в той или иной степени оказывает системное действие, обуславливающее все побочные эффекты.
При терапии цитостатиками возможно возникновение:
- Тошноты и рвоты;
- Язвочек на слизистой рта;
- Признаков недостаточной работы сердца: одышки, нарушении ритма и отеков нижних конечностей;
- Повреждения вены, через которую вводился препарат;
- Повреждения почек;
- Признаков аллергии на химиопрепарат;
- Снижения в общем анализе крови лейкоцитов, эритроцитов (анемия) и тромбоцитов ниже нормы, что говорит об угнетении цитостатиками кроветворения.
- Нарушения сна;
- Головной боли;
- Общей слабости и утомляемости;
- Звона в ушах;
- Нарушений стула: чаще – диареи;
- Нарушений функции печени в виде повышения билирубина и ферментов печени (АЛТ и АСТ) в биохимическом анализе крови;
- Выпадения волос;
- Боли в мышцах (миалгии);
- Увеличения уровня эритроцитов и белка в общем анализе мочи;
- Кровотечений;
- У мужчин – нарушения эрекции.
Повторимся, при системной терапии побочные эффекты выраженнее и возникают чаще, чем при локальной химиотерапии или химиоэмболизации.
Для химиоэмболизации характерны дополнительные возможные побочные эффекты, связанные со способом введения химиопрепарата (непосредственно в кровеносный сосуд):
- Кровотечение из этого сосуда при его повреждении;
- Инфекционное заражение в месте инъекции;
- Ошибочное введение препарата в другой сосуд, и нарушение питания и функции соответствующего этому сосуду органа;
- Болевые ощущения по ходу катетера.
Предпочтительным вариантом терапии ввиду малого системного воздействия является одномоментная химиоэмболизация. Для проведения процедуры используются:
- Доксорубицин;
- Цисплатин;
- Карбоплатин;
- Флоксуридин;
- Эпирубицин;
- Митомицин-С.
Также возможно применение этих и других препаратов для системного лечения. Приведем некоторые примеры схем системной химиотерапии:
- Первый вариант схемы
- Вепезида в 1 и 5 дни терапии;
- Цисплатина – в 1 день;
- 5-Фторурацила – в течение 5 дней непрерывное внутривенное введение.
- Второй вариант схемы
- Интрона А в 1, 3, 5, 7, 9, 11, 13, 15 дни терапии. Введение средства подкожное.
- Фторафура – в 1 и 15 дни.
- Третий вариант схемы.
- 5-Фторурацила во 2 и 7 дни терапии.
- Митомицина-С – в 1 день.
- Вепезида – во 2, 3 и 4 дни.
Вариаций схем лечения множество и подбор осуществляется строго индивидуально и лечащим врачом-онкологом!
Химиопрепараты снижают аппетита и нарушают работу кишечника. Поэтому необходимо скорректировать рацион питания пациента.
За 5-7 до старта лечения химиотерапевты рекомендуют уменьшить порции пищи. Пациенту необходимо питаться маленькими порциями, но ни в коем случае не доводить до голодания, отказаться от жирного, жареного, острого и соленого.
Обязательно присутствие в рационе питания больного:
- Свежих овощей и фруктов;
- Натуральных соков;
- Нежирных творога и молока;
- Пшеничных отрубей;
- Мёда.
После завершения терапии химиопрепаратами пациенту необходимо восстанавливать силы и поэтому надо питаться часто (5-6 раз в день) и маленькими порциями. Питаться можно всем за исключением острого и жирного.
Прогноз для выздоровления зависит от стадии заболевания и тактики врача. В целом, положительный эффект при химиоэмболизации регистрируется в 60-80% случаев.
При обращении пациента в начальной стадии злокачественной болезни пятилетняя выживаемость достигается в 60% случаев. Если пациент начал лечение на второй стадии, 5-летняя выживаемость составит 50%; в третьей стадии – 20%; в четвертой – менее 5%, что связано с распространением метастазов.
источник
Первичные злокачественные опухоли печени составляют менее 2% всех злокачественных новообразований. В 2006 г. в России было выявлено 6183 больных.
Это одна из основных причин смертности от рака в некоторых регионах Африки и Азии.
До 90% всех злокачественных опухолей печени приходятся на гепатоцеллюлярный рак (ГЦР), около 7% — нахолангиоцеллюлярный рак, крайне редко встречается смешанный рак и гепатобластома.
Также редки неэпителиальные опухоли печени — ангиосаркома и другие саркомы. ГЦР чаще заболевают мужчины в возрасте 60 лет и старше.
Основной причиной гепатоцеллюлярного рака являются вирусные гепатиты В и С. Важную роль в развитии ГЦР играет алкогольный цирроз печени, который имеется у 75% больных. В Африке высокая заболеваемость гепатоцеллюлярным раком связана с зараженностью продуктов афлатоксином, продуцируемым грибами Aspergillus flauus и Aspergillus parasiticus.
Анаболические стероиды также могут способствовать развитию гепатоцеллюлярного рака, а отмена гормонов в ряде случаев ведет к регрессии опухоли. Более чем у 70 % больных ГЦР повышен уровень а-фетопротеина (АФП). Ультразвуковая томография позволяет выявить опухоли до 1 см в диаметре. Для подтверждения диагноза необходима биопсия.
Т1 — солитарная опухоль без инвазии сосудов.
Т2 — солитарная опухоль (
Рак толстой кишки включает рак ободочной и прямой кишки. Для его определения часто используют термин «колоректальный рак». По данным МАИР (Международное агентство по изучению рака), колоректальный рак в структуре онкологической заболеваемости у мужчин находится на 4-м месте, у женщин — на 3-.
Неходжкинские лимфомы представляют собой разнородную группу злокачественных опухолей, различающихся между собой по морфологическому строению опухолевой ткани, иммунному типу, клиническим проявлениям, ответу на лечение и прогнозу. Они развиваются из одиночного опухолевого узла и распространяются путе.
источник
При выявлении злокачественного образования в тканях печени онкологи подбирают схему лечения для каждого своего пациента только в индивидуальном порядке.
К сожалению, рак этого органа редко диагностируется на первой стадии его развития, поэтому не все эффективные методы терапии могут применяться.
Комплексный подход к лечению позволяет добиться стойкой ремиссии, но чем раньше человек обратится в медучреждение, тем больше у него шансов на выздоровление.
Рак печени на начальных стадиях практически не вызывает специфических признаков болезни. Обратить внимание можно лишь на появление диспепсических расстройств в виде чрезмерного газообразования, тошноты, горечи во рту.
К группе общих симптомов рака печени относят все признаки, характерные практически для любого онкологического поражения, это:
- Слабость, вялость. Снижение аппетита. Повышение температуры тела. Уменьшение веса. Апатия.
Рост раковой опухоли в печени нарушает функции этого органа, что приводит к появлению диспепсических расстройств. На патологические изменения в печени указывает и увеличение этого органа в размерах, желтушность кожи и слизистых оболочек, зуд тела.
Развиваются стойкие нарушения в работе пищеварения, проявляющиеся метеоризмом, отрыжкой, тошнотой, поносом или запором. На второй-четвертой стадии рака возникают боли, они беспокоят практически постоянно и не уменьшаются при приеме анальгетиков или спазмолитиков.
В запущенных случаях рак печени проявляется асцитом, то есть скоплением жидкости в брюшной полости, внутренними кровотечениями. У больного развивается выраженная кахексия, нарушается работа всех жизненно важных органов – сердца, легких, системы кроветворения.

Помимо удаления части печени или органа целиком применяют:
- Лучевую терапию. Химиотерапию. Метод абляции и эмболизации. Эти способы заключаются во введении в сосуды или саму опухоль специальных веществ, обладающих разрушительным действием.
Для того чтобы добиться полного разрушения или удаления опухоли применяют сразу два-три способа лечения рака. Это позволяет добиться высокой эффективности противораковой терапии и значительно продляет жизнь пациента.
В настоящее время разработано и продолжает разрабатываться еще немало современных методов борьбы с раком, поэтому имеются все основания предполагать, что эта болезнь будет побеждена и на последних стадиях ее развития.
Перед тем как подобрать курс терапии онколог оценивает:
- Размер ракового образования. Количество узлов в печени. Гистологическое строение новообразования. Локализацию в печени опухоли. Наличие метастазов. Имеется ли поражение раковым процессом воротной вены.
Перед выбором лечения обязательно следует установить сопутствующие заболевания, цирроз печени, степень распространения рака по органу. И только на основании всех данных обследования подбирается один из самых оптимальных способов борьбы с болезнью в каждом конкретном случае.
Хирургическое вмешательство по поводу рака печени предусматривает проведение двух видов операции, это удаление самой опухоли или пересадка, то есть трансплантация органа. У обоих этих методов есть свои плюсы и минусы, имеется и много противопоказаний, не позволяющих назначать проведение операций.
- Резекция печени это удаление в ходе операции той части органа, в которой имеется формирующаяся опухоль. Эффективность подобного хирургического вмешательства зависит от размера новообразования, его локализации, распространения раковой опухоли на главные кровеносные сосуды. Легче резецировать левую долю печени, при минимальных по размерам опухолях ограничиваются сегментэктомией. Трансплантация печени эффективна только на начальных стадиях образования злокачественной опухоли. Сложность возникает с подбором донора этого органа, часто приходится долго ждать подходящий биоматериал и за это время рак из начальной стадии переходит в более сложные формы. Современная хирургия в некоторых случаях практикует пересадку части печени от здорового кровного родственника. После трансплантации пациенту назначают лекарства с угнетающим действием на иммунную систему, а их использование может стать катализатором повторного развития атипичных клеток.
Хирургическое вмешательство возможно не всегда и даже если опухоль обнаружена на первой стадии своего развития.
Препятствием к проведению операции считаются:
- Близкое расположение новообразование к воротной вене или проникновение опухоли в ее стенки. При такой локализации рака возможно развитие кровотечения. Метастазы, обнаруженные в рядом расположенных органах и отдаленных участках тела. Цирроз. Данное заболевание не является прямым противопоказанием, но оно значительно уменьшает шансы больного на полное выздоровление. Операция не проводится и если большая часть печени подвержена патологическим изменениям, так как это полностью нарушает ее функцию.
Успешно проведенная операция еще не является залогом полного выздоровления пациента с раком этого органа. После операции сохраняется риск рецидива болезни, так как раковые клетки могут сохраниться в здоровых тканях и начать постепенно развиваться через несколько месяцев.

Подобная методика лечения раковых больных имеет разные варианты проведения:
- Наружное облучение – традиционный вариант. Излучение отходит от аппарата, помещенного на некотором расстоянии от тела пациента. Облучающий луч направляется прямо на место локализации опухоли, один сеанс занимает по времени несколько минут. Основная опасность этого метода для пациента – одновременное облучение рядом расположенных здоровых клеток печени. 3D-КЛТ – трехмерная конформная лучевая терапия. При этом методе облучения локализация опухоли определяется при помощи компьютерной программы, что позволяет пучок рентгеновских лучей направить строго на новообразование. Облучение проводится под тремя разными углами, что обеспечивает высокую эффективность процедуры. СТЛТ – стереотаксическая лучевая терапия. Этот метод заключается в использовании пучка излучения с самой максимальной мощностью. Несколько сфокусированных лучей одновременно подводят к новообразованию сразу с нескольких сторон. Во время сеанса пациента помещают в специальную рамку, необходимую для более точного подведения излучения к опухоли. Радиоэмболизация. Это один из новейших методов лечения – в печеночную артерию пациента вводят радиоактивные частицы, они локализуются рядом со злокачественной опухолью. Выделяемое радиоактивными элементами излучение губительно действует на раковые клетки.
Суть химиотерапии при раке печени заключается во введении в организм пациента препаратов, оказывающих на раковые клетки разрушительное действие.
Системная химиотерапия заключается во введении лекарств через вену или в виде таблеток через рот. Основные компоненты химиопрепаратов разносятся кровью по всему организму и выполняют свою работу.
Но эта особенность химиолечения влияет и на развитие множества побочных эффектов, так как лекарства разрушают не только раковые клетки, но и затрагивают здоровые. Системная химиотерапия используются, если помимо основного очага уже есть и метастазы в других органах.
Рак печени плохо поддается устранению при помощи введенных через рот или вену препаратов, поэтому на сегодня используется и другой способ введения препаратов – прямо в печеночную артерию.
Инфузия препаратов таким способом носит название ИПА, лекарственные компоненты при этом способе попадают во все части печени, а в другие органы практически не попадают. ИПА уменьшает выраженность побочных эффектов и увеличивает разрушение раковой опухоли. Непосредственно в печеночную артерию вводятся такие препараты как Цисплатин, Митомицин С, Флоксуридин, Доксорубицин.
Не всем пациентам с раком печени возможно проведение химиотерапии или хирургического вмешательства. В случае абсолютных противопоказаний к этим методам лечения подбирают альтернативные или обходные пути борьбы с раком.
Абляция может выполняться при помощи криодеструкции, высокоэнергетических радиоволн, тепла. Процедура проводится под контролем УЗИ аппарата, метод является органосохраняющим и таким образом не происходит нарушения функционирования печени.

В первую очередь пища должна быть витаминизированной, легкоусвояемой и она должна снижать последствия раковой интоксикации и химиотерапии.
Обязательно на столе ежедневно должны присутствовать растительные и молочнокислые продукты, рекомендуется есть жирные сорта рыбы, каши, пить компоты, отвары трав и шиповника.
Отказаться следует от копченостей, маринованных и слишком соленых блюд, газировки, алкоголя.
Дробное питание небольшими порциями уменьшает нагрузку на пищеварение и является профилактикой диспепсических расстройств.
Примерно в 75% случаев проведение лечения на ранних стадиях рака печени обеспечивает пятилетнюю выживаемость. То есть злокачественное поражение печени победить можно, но необходимо вовремя выставить этот диагноз.
Многое в выздоровлении зависит от возраста пациента, наличия у него сопутствующих заболеваний, настроя на лечения. Резекция одной доли печени в случае отсутствия раковых клеток в другой доли дает высокие шансы на полное избавление от заболевания.
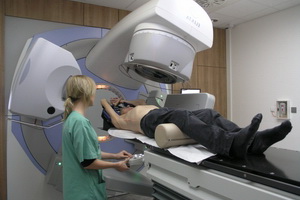
Химиотерапия — это лечение какого-либо паразитарного, инфекционного или онкологического заболевания посредством введения ядов и токсинов, губительно действующих на повреждающий фактор. Надо обратить внимание на частое употребление слова «избирательный», причем в современной трактовке оно не используется, так как в данном случае яды и токсины влияют и на здоровые ткани и системы организма. К сожалению, кроме как химиотерапия при раке печени 4 стадии, иного способа воздействовать на опухоль нет.
Следует сказать, что химия при раке печени может применяться как отличное эффективное дополнение в случае проведения успешной операции. Дело в том, что ни один хирург не может дать гарантию, полностью ли была удалена опухоль или все же остались единичные раковые клетки, способные снова дать злокачественный рост. Именно поэтому врачам и приходится назначать лечение рака печени химиотерапией – столь неприятной для пациента процедурой.
Какая химия делается при раке печени и как вводятся лекарства? Существует множество наименований препаратов для химиотерапии при раке печени; можно даже не знать их всех, тем более что каждый год этот перечень пополняется десятками новых названий. Нужно уделить внимание другому: способам введения препарата при химиотерапии печени, а также реабилитации пациента непосредственно во время и после процедуры.
Терапия при раке печени химией обычно выполняется внутривенно, однако это не означает, что врачи не ищут новых путей «доставки» лекарств к больному органу. Буквально в прошлом году с успехом стартовали клинические испытания американских хирургов, которые смогли изобрести способ доставки «яда» посредством лимфатических протоков. Такой способ введения ещё двадцать лет назад получил название «эндолимфатический». Но до сегодняшнего дня при терапии химией метастазов печени не представлялось возможности проводить подобные курсы.
Медицина не стоит на месте, однако заметим, что пока данный метод находится на стадии тестирования и апробации результатов. Большинство медиков в один голос заявляют, что при раке печени нужна химия, а принимать внутрь какие-либо таблетированные препараты не эффективно — на рак они едва ли повлияют.
Как принимать химию при заболевании печени раком, чтобы лечение было эффективным? Химиотерапия при онкологии печени выполняется курсами — по неделям, — после которых дается небольшой перерыв, и все повторяется снова. Если вы видели упаковку с препаратом, вы никогда не забудете ее. Внешне она представляет собой непрозрачную емкость, которую персонал переносит только в перчатках, реже — в специальных защитных костюмах. Эти меры предосторожности при лечении печени химиотерапией оправданны, однако пациента необходимо проинформировать, что он, по возможности, также должен избегать попадания действующего вещества из флакона на кожу, в том числе и во время вливания. На рак печени препарат таким способом не подействует, а вот вызвать дерматит вполне может — такие случаи нередки.
Многие пациенты опасаются выпадения волос, появления необратимых изменений в органах и системах человека. Препарат, к сожалению, губит не только раковые клетки, но и нормальные, здоровые — он лишен какой-либо избирательности. Очевидно, что рост волос может остановиться, вероятно, будет наблюдаться их ломкость; но спустя неделю все физиологические процессы восстанавливаются. Полное облысение наблюдается крайне редко, этого не стоит бояться, но, конечно, морально необходимо быть готовым. Пациентам нужно знать, что им придется часами неподвижно лежать под капельницами, с короткими перерывами на еду и туалет. Влияние химиотерапии на печень и другие органы не проходит бесследно, лечение часто «расшатывает» психику, и без того потрепанную онкопатологией.
По непонятным причинам, врачи не говорят, что отнюдь не небольшая часть препаратов способна даже непосредственно изменить психический статус человека, влияя на центральную нервную систему. Кто-то сравнивает такую ситуацию с интоксикацией, например, при гриппе, когда пациент сначала возбужден, а потом наблюдается прямо противоположная стадия — угнетение. Трудно предугадать все психические изменения, но об этом обязательно стоит предупреждать как самого больного, так и его родственников. Этот период времени — самый ответственный для всех окружающих пациента, когда больному как никогда требуется поддержка. Отметим, что когда больной знает об успешно проведенной операции, химиотерапия воспринимается им как заключительное обязательное звено и переносится намного легче.
Часто прогнозы химиотерапии при раке печени неутешительны, и если больной знает, что удалить раковую опухоль невозможно, врачи проводят только симптоматическую терапию, а рак, скорее всего, так и будет развиваться — вопрос только во времени, — необходимо проявлять чуткость к пациенту. Это касается как медицинского персонала, так и родственников.
Нарушения со стороны психической деятельности человека — отнюдь не единственные побочные проявления подобного лечения. Возможны такие последствия химиотерапии печени, как проблемы, связанные с пищеварительным трактом. А именно: постоянная тошнота, рвота, причем временами неукротимая, понос, чередующийся с запорами, сниженный аппетит (возможно его отсутствие). Одним словом, самый разнообразный перечень симптомов, который только можно описать при заболеваниях желудочно-кишечного тракта, подходит и для химиотерапии. Разумеется, их стоит ожидать. Ни один врач точно не скажет, будет ли у больного рвота, понос или иное, но готовиться следует ко всему.
Что касается вопроса о количестве сеансов химиотерапии при метастазах в печени, их продолжительности, дозы лечения — сказать что-либо определенное нельзя. Во-первых, в настоящее время — и так будет еще долго — все консервативные способы лечения онкологических заболеваний находятся на стадии открытия и тестирования, т. е. каждый опытный врач ищет свои пути решения проблемы, подбирает препараты и их дозировку, тем более, когда жизнь пациента зависит именно от этого. Во-вторых, все пациенты индивидуальны, как и их заболевание, хоть и подразумевается общий раковый процесс: многое зависит от индивидуальных особенностей организма человека. Немаловажно сказать и об операбельности или неоперабельности пациента — это абсолютно разные схемы лечения, зависящие во многом от мастерства врача.
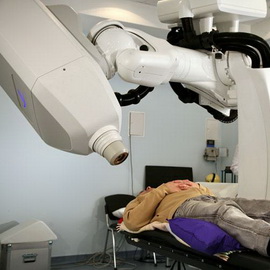
Несколько десятилетий назад, когда облучение печени и других пораженных раком органов только входило в широкую медицинскую практику, существовало такое понятие, как лучевой дерматит — осложнение, характеризующееся воспалением кожных покровов в ответ на излучение. В настоящее время не стоит бояться ничего подобного. Клиники основных городов РФ оборудованы аппаратами, позволяющими дозированно и, главное, локально направлять лучи на ту область тела человека, где и находится раковая опухоль. Крайне высокую популярность данный метод приобрел при лечении злокачественных опухолей кожи, а также при лечении рака простаты. Если вести разговор о раке печени, то в данном случае используется как общее, так и локальное излучение.
Дело в том, что, ни один врач не даст гарантию отсутствия метастазов. Поскольку при раке печени имеется очень быстрая тенденция к метастазированию, зачастую врачам приходится прибегать к «непопулярным» мерам назначения общего или тотального облучения. Какие же проблемы могут возникнуть у пациентов при лучевой терапии? В первую очередь, необходимо сказать об ответной реакции со стороны кожи в виде воспалительной реакции, что в медицине получило название «дерматит». Не стоит думать, что при локальном облучении подобная проблема может не встретиться — ведь лучевому воздействию подвергается только небольшой участок кожи величиной с ладонь. Вот в этом месте и может развиться дерматит. Безусловно, речь не идет о масштабных поражениях, но может возникнуть определенный дискомфорт.
Как же лечить подобное осложнение после лучевой терапии печени или другого органа? Как бы это парадоксально ни звучало — никак. Если вы увидели небольшое шелушение или покраснение кожи, то иногда врач-радиолог прерывает сеансы процедуры, но в целом нет необходимости это делать.
Некоторую опасность во время лучевой терапии при метастазах печени представляют такие осложнения, как язвенные поражения кожи. В этом случае требуется напрямую проконсультироваться у дерматолога и без оговорок следовать его рекомендациям — ведь пациенту необходимо как можно скорее снова приступить к облучению. Поскольку лучевая терапия оказывает свое губительное влияние на все быстро делящиеся клетки, то у пациента могут развиться симптомы недостаточности функции тромбоцитов, лейкоцитов, эритроцитов. Если в большинстве случаев можно и не заметить снижение двух последних перечисленных форменных элементов крови, то относительно тромбоцитов такого сказать нельзя. Они являются не только факторами образования кровяного сгустка, но и питают сосудистую стенку. Если возникает их недостаточность, сосуды не только не способны быстро тромбироваться в случае их повреждения в бытовых условиях, но и становятся хрупкими по причине нехватки питательных веществ.
Клинически пациент будет жаловаться на гематомы, «красные высыпания» и даже кровотечения из ран, если таковые имеются на теле.
К сожалению, ошибочно распространена информация о возможных тяжелых внутренних кровотечениях, приводящих к летальному исходу в течение часа. В современном мире, когда дозы облучения подобраны в течение уже не одного года; поэтому трудно даже по памяти вспомнить последнего пациента, страдающего обильными кровотечениями вследствие облучения.
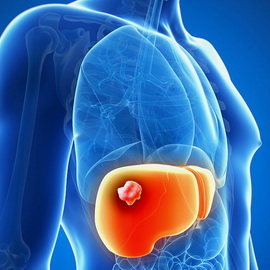
Однако ошибочно полагать, что при наличии метастазов эффективность химиотерапии при раке печени 4 стадии сводится к нулю, и уже ничего не поделаешь. Конечно, нужно пробовать все возможные способы, нужно искать верную дозу, стремясь приостановить рост метастазов.
В онкологии во время врачебных дискуссий относительно лечения рака печени с метастазами курсом химиотерапии врачи не имеют единого мнения по этому поводу. Но ничего не делать, чтобы облегчить страдания пациента, не искать возможные пути — едва ли правильный путь, даже с точки зрения психологии.
Существуют ли противопоказания к химиотерапии и лучевой терапии, в особенности, при метастазах? Безусловно, они есть. Одним из противопоказаний служит индивидуальная непереносимость организмом пациента химиопрепаратов и лучевого воздействия. Например, могут иметь место неукротимая рвота, выраженное возбуждение больного, помутнение рассудка, аллергия. По возможности, каждый врач должен предупредить подобные осложнения или снизить их до минимума, чтобы они не доставляли серьезных неудобств пациенту. К сожалению, этого не всегда можно добиться.
Кстати говоря, данное понятие носит весьма «растяжимый» характер; более того, грамотному онкологу необходимо уметь отличать «психическую непереносимость» от физиологической. В последнее время на эту тему публикуются десятки научных трудов, в которых приводится статистика, согласно которой свыше 60% всех осложнений или надуманы пациентами, или спровоцированы ими. Вы можете задать логичный вопрос: как можно вызвать у себя аллергию, рвоту или дерматит? С нарушениями психической сферы все, казалось бы, понятно, но вы будете приятно удивлены, точно так же как и английские врачи, решившие провести любопытные исследования. Были выбраны две группы пациентов с онкологией, и одной группе помимо химиотерапии и лучевого воздействия назначались индивидуально подобранные дозы успокоительного, а контрольной группе лечение назначалось согласно стандартам. Каково же было удивление медиков, когда в контрольной группе наблюдалось на 20 — 30% меньше осложнений любого характера, включая воспалительные и аллергические проявления.
Для профилактики осложнений родственники и медицинский персонал должны проявлять сочувствие и максимальную чуткость. Не стоит самостоятельно покупать их больному или обращаться за их назначением к другому специалисту, кроме врача-психиатра. Их избыточный прием может «смазать» картину основного заболевания, навести врача на ложный путь лечения. Это также необходимо пациентам взять за правило.
Менее частым, но, тем не менее, важным противопоказанием к проведению химиотерапии и лучевой терапии служат сопутствующие болезни, особенно в стадии обострения. Конечно, речь не идет о хроническом бронхите, насморке или пиелонефрите. Львиную долю занимают гематологические заболевания, например хронический лейкоз, тромбоцитопения или гемофилия. При облучении, в крови снижается содержание тромбоцитов и лейкоцитов.
В целом большая часть больных не имеют существенных противопоказаний к химио — и лучевой терапии.
источник