Когда запасы углеводов в организме становятся ниже нормы, некоторое количество глюкозы может образовываться из аминокислот и составной части жиров — глицерола. Этот процесс называют глюконеогенезом.
Глюконеогенез особенно важен для предупреждения существенного снижения уровня глюкозы в крови во время голодания. Глюкоза является основным субстратом, используемым для получения энергии такими тканями, как нервная ткань и клетки крови, поэтому в крови должно присутствовать достаточное количество глюкозы в промежутках между приемами пищи, которые могут составлять несколько часов.
Печень играет ключевую роль в поддержании уровня глюкозы в крови натощак, обеспечивая превращение депонированного гликогена в глюкозу (гликогенолиз), а также путем синтеза глюкозы, главным образом из лактата и аминокислот (глюконеогенез). Приблизительно 25% глюкозы, синтезированной печенью натощак, образуется путем глюконеогенеза, что способствует доставке необходимого мозгу количества глюкозы.
В условиях длительного отсутствия пищи значительное количество глюкозы может образовываться в почках из аминокислот и других предшественников.
Приблизительно 60% аминокислот из присутствующих в организме белков свободно превращаются в углеводы. Остальные 40% имеют химическую структуру, затрудняющую их превращение в углеводы или делающую этот процесс невозможным. Превращение каждой аминокислоты в глюкозу сопряжено с индивидуальными особенностями химических реакций.
Например, путем дезаминирования аланин может напрямую превращаться в пировиноградную кислоту; затем пировиноградная кислота превращается в глюкозу или запасается в виде гликогена. Большая часть используемых аминокислот может объединяться, превращаясь в различные сахара, содержащие 3, 4, 5 и даже 7 атомов углерода. Затем они вступают в фосфоглюконатные реакции и преобразуются в глюкозу.
Таким образом, путем дезаминирования и некоторых простых преобразований большое количество аминокислот становится глюкозой. Подобным способом глицерол также преобразуется в глюкозу или гликоген.
Регуляция глюконеогенеза. Уменьшение количества углеводов в клетках или снижение сахара в крови является основным стимулом для увеличения скорости глюконеогенеза. Кроме того, уменьшение количества углеводов может стать причиной изменения направления гликолитических или фосфоглюконатных реакций, что способствует превращению дезаминированных аминокислот в углеводы, наряду с глицеролом. Такой гормон, как кортизол, играет особенно важную роль в регуляции процессов глюконеогенеза.
Роль кортикотропина и глюкокортикоидов в глюконеогенезе. Если количество углеводов в клетках не соответствует нормальному уровню, это по не совсем понятной причине приводит к тому, что аденогипофиз начинает продуцировать большое количество гормона кортикотропина. Кортикотропин стимулирует кору надпочечников к продукции больших количеств глюкокор-тикоидных гормонов, особенно кортизола.
В свою очередь, кортизол мобилизует белки из большинства тканей организма, повышая уровень аминокислот в жидких средах организма. Большая часть выделяемых аминокислот сразу дезаминируется в печени и становится прекрасным субстратом для превращения в глюкозу. Таким образом, один из наиболее важных способов стимуляции глюконеогенеза опосредован выделением глюкокортикоидов из коры надпочечников.
Нормальная концентрация глюкозы в крови, взятой натощак спустя 3-4 ч после приема пищи, составляет 90 мг/дл. После приема пищи, содержащей большое количество углеводов, уровень глюкозы в крови иногда достигает почти 140 мг/дл, даже если у человека нет сахарного диабета.
Регуляция концентрации глюкозы в крови тесно связана с гормонами поджелудочной железы, инсулином и глюкагоном.
источник
№ 28 После предшествующего 5-часового перерыва в приеме пищи, студентка выпила сладкий чай с пирожным. Как изменится обмен углеводов в печени в этой ситуации? При ответе представьте схемы, объясняющие как гормоны «переключают» обмен углеводов в печени при переходе от постабсорбтивного состояния к абсорбтивному.
Углеводы пойдут на синтез жиров и произойдёт их депонирование, также произойдёт активация аэробного гликолиза и синтез гликогена.
Синтез жирных кислот Синтез гликогена (ниже)
№ 29 Спортсмен совершает 5-километровую пробежку. Укажите, поток каких метаболитов увеличивается из мышц в печень к концу дистанции. Напишите краткие схемы возможных превращений этих веществ в печени в данной ситуации. Объясните значение этих процессов.
У спортсмена совершающего пробежку в интенсивно работающих мышцах происходят процессы гликолиза, при этом в результате анаэробного гликолиза (в первые минуты — при нехватке кислорода (затем идет аэробный), и при длительной работе) образуется лактат. Он вступает в «глюкозо-лактатный цикл», или цикл «Кори».
В печени отношение NADH\NAD+ ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в сторону образования пирувата из лактата. Далее пируват включается в глюкогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами.
1) утилизация лактата — предотвращение лактоацидоза;
При длительной мышечной работе могут образовываться аминокислоты, в результате распада мышечных белков, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла (гликогенный аминокислоты) и способны включаться в глюконеогенез.
Значение: транспорт аминного азота из мышц в печень и предотвращение лактоацидоза.
№ 30 При длительной физической работе в крови повышается концентрация лактата. Объясните, как лактат может использоваться в этой ситуации в миокарде, напишите схему соответствующего метаболического пути.
Пируват потом переходит в ЦТК.
№ 33 Основное значение регуляции скоростей синтеза и распада гликогена в печени заключается в поддержании постоянной концентрации глюкозы в крови. Укажите концентрацию глюкозы в крови в норме. Объясните роль гормонов в регуляции активности ключевых ферментов обмена гликогена. Ответ проиллюстрируйте соответствующими схемами.
Концентрация глюкозы в норме: 3,3-5,5 ммоль/л (60-100 мг/дл).
Гормоны, регулирующие метаболизм гликогена: инсулин и глюкагон. Первичный сигнал для их синтеза — изменение концентрации глюкозы в крови. При повышении инсулин/глюкагонового индекса идет синтез гликогена, при понижении — распад.
Механизм действия глюкагона:
Так же на обмен гликогена может влиять адреналин в экстремальной ситуации.
Какая система передачи сигнала в клетку будет использована, зависит от рецепторов, с которыми взаимодействует адреналин.
№ 32 Из клеток печени двух крыс был выделен бифункциональный фермент (БИФ), в фосфорилированной и дефосфорилированной формах, имеющих разную ферментативную активность. Объясните особенности функционирования этого фермента. Какую роль играет БИФ в регуляции обмена углеводов в печени животных?
Б
В реакции фосфорилирования фруктозо-6-фосфата фермент проявляет киназную активность, а при дефосфорилировании образованного фруктозо-2,6-бисфосфата — фосфатазную. Это обстоятельство и определило название фермента «бифункциональный».
Киназная активность БИФ проявляется, когда фермент находится в дефосфорилированной форме (БИФ-ОН). Дефосфорилированная форма БИФ характерна для абсорбтивного периода, когда инсулин/глюкагоновый индекс высокий. В этот период количество фруктозо-2,6-бисфос-фата увеличивается.
При низком инсулин-глюкагоновом индексе, характерном для периода длительного голодания, происходит фосфорилирование БИФ, и он функционирует как фосфатаза. Результат — снижение количества фруктозо-2,6-бисфосфата.
Киназную и фосфатазную реакции катализируют разные активные центры БИФ, но в каждом из двух состояний фермента (фосфорили-рованном и дефосфорилированном) один из активных центров ингибирован. Регуляторное влияние фруктозо-2,6-бисфосфата заключается в том, что он аллостерически активирует фосфофруктокиназу (фермент гликолиза). При этом фруктозо-2,6-бисфосфат снижает ингибирующее действие АТФ на этот фермент в абсорбтивном периоде и повышает его сродство к фруктозо-6-фосфату. В то же время фруктозо-2,6-бисфос-фат ингибирует фруктозо-1,6-бисфосфатазу (фермент глюконеогенеза). Итак, в абсорбтивном периоде уровень фруктозо-2,6-бисфосфата повышается, что приводит к активации фосфофруктокиназы и ускорению гликолиза. Результатом уменьшения количества фруктозо-2,6-бисфосфата в постабсорбтивном периоде будет снижение активности фосфофруктокиназы, замедление гликолиза и переключение гликолиза на глюконеогенез.
№ 31 При смене абсорбтивного состояния на постабсорбтивное в печени происходит переключение гликолиза на глюконеогенез. Каким образом изменение секреции гормонов и метаболитов регулирует этот процесс? Ответ аргументируйте соответствующими схемами.
Количество инсулина падает, а глюкагона возрастает. В печени скорость синтеза жирных кислот уменьшается, а скорость β-окисления и синтеза кетоновых тел увеличивается. В жировой ткани скорость синтеза ТАГ уменьшается.
Происходит изменение активности и количества ферментов гликолиза и глюконеогенеза.
№ 34 На дистанции два бегуна: спринтер завершает стометровку, стайер бежит десятый километр. Укажите различия в энергетическом обеспечении работы мышц у этих бегунов. Приведите схемы метаболических путей в обмене углеводов и липидов, которые являются источником энергии у стайера и спринтера.
У спринтера происходит анаэробный гликолиз, так как невозможно так быстро обеспечить мышцы необходимым количеством кислорода. У стайера функционирует β-окисление жирных кислот и аэробный гликолиз.
У стайера – β-окисление жирных кислот и аэробный гликолиз
Аэробное окисление глюкозы до CO2 и воды
Выход АТФ: -1 -1+2(3 + 1+ 1)+15*2=38 АТФ
У спринтера – анаэробный гликолиз.
№ 35 Использование скелетными мышцами жирных кислот в качестве источника энергии зависит от их концентрации в крови. Укажите ситуации, при которых концентрация жирных кислот в крови может увеличиваться и напишите схему, описывающую использование жирных кислот в качестве источника энергии.
Концентрация жирных кислот в крови увеличивается в при голодании и длительной физической работе за счёт мобилизации из жировых депо.
№ 36 Студент А. получил в составе пищи только 200г углеводов, а студент В. — только 60г жиров. Через 2 часа у обоих студентов концентрация триацилглицеролов в крови увеличилась. Составьте схемы, объясняющие разницу в составе липопротеинов в крови у этих студентов после еды.
В данной задаче инсулин-глюкагоновый индекс повышается.
У первого студента в печени и жировой ткани идет синтез жиров из глюкозы , при этом, за счет синтеза жиров в печени, в крови увеличивается фракиця ЛПОНП, транспортирующая триациглиролы в жировую ткань (активируются и индуцируются ключевые ферменты синтеза жирных кислот).
У второго студента происходит транспорт триациглицеролов из кишечника в составе хиломикронов. В крови на ХМ и ЛПОНП действует ЛП-липаза,. В результате гидролиза триацилглицеролов жирные кислоты поступают в адипоциты и используются для синтеза жиров.
Далее хиломикроны идут в кровь
№ 38 После введения животным в течение нескольких дней глюкозы, содержащей меченые атомы углерода (С 14 ), обнаружили, что метка появляется в изопентенилпирофосфате, а затем в структуре желчных кислот. Как это происходит? Для ответа на вопрос:
а) Объясните, в каком процессе изопентенилпирофосфат является промежуточным метаболитом и будет ли сохраняться радиоактивная
метка в конечном продукте процесса;
б) Напишите схему включения С 14 в состав желчных кислот и укажите орган, в котором это происходит;
в) Укажите, будет ли сохраняться в организме животных меченые по С 14 желчные кислоты, после прекращения введения меченой глюкозы.
а) Синтез холестерола в цитозоле клеток печени. Метка будет сохраняться.
Стрелками показана регуляция. От дезоксихолевой стрелка идёт к холестеролу
в) Не будут сохраняться, а будут медленно выводиться с фекалиеми в виде чистого хоестерола и в виде желчных кислот,а также с кожным салом.
№ 37 При обследовании пациента с атеросклерозом коэффициент атерогенности оказался равным 5,3. Напишите формулу для расчета коэффициента, укажите возможные причины его увеличения. Объясните функции различных липопротеинов в транспорте холестерола.
1. Потребление высококалорийной пищи, а такжн пищи, содержащей много холестерола
2. Генетический дефект любого из Б., участвующих в метаболизме Хм.
3. Мутация гена ЛПП, Апо-с-II
1. Хм – транспорт липидов из клеток кишечника.
2. ЛОНП – транспорт липидов, синтезируемых в печени.
3. ЛППП – промежуточная форма превращения ЛОНП → KYG под действием ЛП-липазы.
4. ЛПНП – транспорт холестерола вткани
5. ЛПВП – удаление избыточного холестерола из клеток и других липопротеинов, донор апопротеинов А, C-II.
№ 39 При одинаковом питании у одних людей ожирение развивается быстрее, чем у других. Для объяснения этого:
а) Изобразите схемы метаболических путей, активация которых приводит к увеличению веса;
б) Назовите гормон, под влиянием которого это происходит, и объясните механизм его действия;
в) Укажите возможные причины (кроме гиперкалорийного питания) ожирения.
а) Депонирование жира в адипоцитах
После еды при повышении концентрации глюкозы в крови увеличивается секреция инсулина. Инсулин активирует транспорт глюкозы внутрь адипоцитов, действуя на ГЛЮТ-4, и синтез ЛП-липазы в адипоцитах и её экспонирование на поверхности стенки капилляров. ЛП-липаза, связанная с эндотелием сосудов, гидролизует жиры в составе ХМ и ЛПОНП. АпоС-П на поверхности ХМ и ЛПОНП активирует ЛП-липазу. Жирные кислоты проникают в адипоцит, а глицерол транспортируется в печень. Так как в адипоцитах нет фермента глицеролкиназы, то свободный глицерол не может использоваться для синтеза ТАГ в этой ткани. Активированные жирные кислоты взаимодействуют с глицерол-3-фосфатом, образующимся из дигидроксиацетонфосфата, и через фосфатидную кислоту превращаются в ТАГ, которые депонируются в адипоцитах. Сокращения: ТАГ* — триацилглицеролы в составе ХМ и ЛПОНП; ДАФ — дигидроксиацетонфосфат.
1 – фосфорилированный рецептор инсулина фосфорилирует субстраты инсулинового рецептора. 2 – образование комплекса Фосфоинозитол-3-киназы с активированными субстратами инсулинового рецептора. 3 – активация протеинкиназы В 4 – протеинкиназа В активирует фосфодиэстеразу путём фосфорилирование. 5 – фосфодиэстераза Катализирует реакцию превращения цАМФ в АМФ.
в) Избыточное потребление жиров и углеводов, низкий уровень физической активности, психологические факторы, генетические нарушения (более прочное сопряжение дыхания и фосфорилирования, малая доля анаэробного гликолиза, дефект рецепторов лептина), ожирение вследствие другой патологии (гипотиреоз).
№ 40 Для установления риска развития атеросклероза, помимо определения общего холестерола в крови, дополнительно рассчитывают коэффициент атерогенности. Напишите схему синтеза холестерола, формулу для расчета коэффициента и объясните:
а) Почему в расчете коэффициента необходимо учитывать уровень ЛПВП в крови:
б) Метаболизм ЛПВП (формирование, взаимодействие с другими липопротеинами т.д.).
Синтез холестерола в цитозоле клеток печени.
а) ЛВП освобождают ткани от Хс и транспортируют его в печень.
1. Поставляют апопротеины другим ЛП в крови
2. Участвуют в так называемом «обратном транспорте холестерола»
Синтезируются ЛВП в печени и токном кишечнике.
Незрелые ЛПВП-предшественники обогащаются хопестеролом, который поступает в ЛПВП при участии фермента ЛХАТ с поверхности клеток и других липопротеинов, содержащих холестерол. Незрелые ЛПВП, обогащаясь холестеролом, превращаются в ЛПВП3 — частицы сферической формы и большего размера. ЛПВП3обменивают эфиры холестерола на триацилглицеролы, содержащиеся в ЛПОНП, ЛППП при участии «белка, переносящего эфиры холестерола»*. ЛПВП3 превращается в ЛПВП2, размер которых увеличивается за счёт накопления триа-цилглицеролов. ЛПОНП и ЛППП под действием ЛП-липазы превращаются в ЛПНП, которые доставляют холестерол в печень. Часть ЛПВП захватывается клетками печени, взаимодействуя со специфическими для ЛПВП рецепторами к апоА-1. На поверхности клеток печени фосфолипиды и триацилглицеролы ЛППП, ЛПВП2 гидролизуются печёночной ЛП-липазой**, что дестабилизирует структуру поверхности ЛП и способствует диффузии холестерола в гепатоциты. ЛПВП2 в результате этого опять превращаются в ЛПВП3 и возвращаются в кровоток. X — холестерол, ЭХ — эфиры холестерола, ФЛ — фосфолипиды, ЛХАТ — лецитин-холестеролацилтрансфераза, А-1 — апопротеин, активатор ЛХАТ.
№ 41 Каковы особенности метаболизма жиров у человека, получающего высококалорийную пищу с повышенным содержанием легко усвояемых углеводов? Для ответа на вопрос:
а) Напишите регуляторную реакцию синтеза жирных кислот и схему синтеза жиров из углеводов;
б) Объясните особенности гормональной регуляции этих процессов при избыточном углеводном питании.
а) Регуляторная реакция — Образование малонил-КоА.
Регуляторный фермент – ацетил-КоА-карбоксилаза
Схема синтеза жиров из углеводов.
1 – окисление глюкозы до пирувата и окислительное декарбоксилирование пирувата приводят к образованию ацетил-КоА; 2 – ацетил-КоА является строительным белком для синтеза жирных кислот; 3 – жирные кислоты и α-глицеролфосфат, образующися в реакции восстановления дигидроксиацетонфосфата, участвует в синтезе триацилглицеролов.
б) Длительное потребление богатой углеводами и бедной жирами пищи приводит к увеличению секреции инсулина, который стимулирует индукцию синтеза ферментов: ацетил-КоА-карбоксилазы, синтазы жирных кислот, цитратлиазы, изоцитратдегидрогеназы. Следовательно, избыточное потребление углеводов приводит к ускорению превращения продуктов катаболизма глюкозы в жиры. Голодание или богатая жирами пища приводит к снижению синтеза ферментов и, соответственно, жиров.
В постабсорбтивном состоянии или при физической работе глюкагон или адреналин через аденилатциклазную систему активируют протеинкиназу А и стимулируют фосфорилирование субъединиц ацетил-КоА карбоксилазы. Фосфорилированный фермент неактивен, и синтез жирных кислот останавливается. В абсорб-тивный период инсулин активирует фосфатазу, и ацетил-КоА карбоксилаза переходит в дефосфорилированное состояние. Затем под действием цитрата происходит полимеризация протомеров фермента, и он становится активным. Кроме активации фермента, цитрат выполняет и другую функцию в синтезе жирных кислот. В абсорбтивный период в митохондриях клеток печени накапливается цитрат, в составе которого остаток ацетила транспортируется в цитозоль.
№ 42 Человек получил с пищей 250 грамм углеводов и в течение 2-х часов не совершал физической работы. Опишите изменения жирового обмена, происходящие в организме человека в течение этого времени с помощью соответствующих схем, объясните роль гормонов в регуляции этих процессов.
В данной задаче инсулин-глюкагоновый индекс повышается.
В печени и жировой ткани идет синтез жиров из глюкозы, при этом, за счет синтеза жиров в печени, в крови увеличивается фракиця ЛПОНП, транспортирующая триациглиролы в жировую ткань (активируются и индуцируются ключевые ферменты синтеза жирных кислот).
Далее жир депонируется в адипоцитах в абсорбтивный период
Инсулин активирует ацетил-КоА-карбоксилазу, регуляторный фермент в биосинтезе жирных кислот. К тому же инсулин может индуцировать синтез ферментов биосинтеза ЖК за счет усиления транскрипции с соответствующих генов (ген ацетил-КоА-карбоксилазы, синтазы жирных кислот, цитратлиазы, изоцитратдегидрогеназы). Плюс ко всему, инсулин вызывает усиление гликолиза, а продукты гликолиза (ацетил-КоА, НАДФН, ДАФ) являются исходными компонентами для синтеза жирных кислот и жиров.
№ 43 В крови голодающего человека возрастает концентрация кетоновых тел. Объясните причины и механизмы, приводящие к усилению синтеза кетоновых тел. Для этого:
а) Укажите уровень каких гормонов повышен в крови этого человека;
б) Напишите схемы метаболических путей, которые активируют эти гормоны в печени, укажите ключевые реакции и механизмы их регуляции.
в) Назовите причину, объясняющую более высокую концентрацию в крови β-гидроксибутирата по сравнению с ацетоацетатом.
Глюконеогенез (снизу-вверх) Распад гликогена
Также в механизме можно упомянуть о распаде гликоегна в течение 24 часов, расщеплении жира и ЦТК.
в) Ацетоацетат может выделяться в кровь или превращаться в печени в другое кетоновое тело — β-гидроксибутират путём восстановления. В клетках печени при активном β-окислении создаётся высокая концентрация NADH. Это способствует превращению большей части ацетоацетата в β-гидроксибутират, поэтому основное кетоновое тело в крови – именно β-гидроксибутират.
№ 44 Человек получил 250 г углеводов за один прием пищи и в течение 2 часов не совершал физической работы. Какой процесс обмена жирных кислот будет активироваться в печени через 2 ч после еды? Изобразите схему метаболического пути жирных кислот выбранного вами и укажите, какой гормон и каким образом может стимулировать данный метаболический путь.
В данной задаче инсулин-глюкагоновый индекс повышается.
В печени и жировой ткани идет синтез жиров из глюкозы , при этом, за счет синтеза жиров в печени, в крови увеличивается фракция ЛПОНП, транспортирующая триациглицеролы в жировую ткань (активируются и индуцируются ключевые ферменты синтеза жирных кислот).
Далее происходит транспорт триациглицеролов из кишечника в составе хиломикронов. В крови на ХМ и ЛПОНП действует ЛП-липаза,. В результате гидролиза триацилглицеролов жирные кислоты поступают в адипоциты и используются для синтеза жиров.
Далее хиломикроны идут в кровь
Далее жир депонируется в адипоцитах в абсорбтивный период
Инсулин активирует ацетил-КоА-карбоксилазу, регуляторный фермент в биосинтезе жирных кислот. К тому же инсулин может индуцировать синтез ферментов биосинтеза ЖК за счет усиления транскрипции с соответствующих генов (ген ацетил-КоА-карбоксилазы, синтазы жирных кислот, цитратлиазы, изоцитратдегидрогеназы). Плюс ко всему, инсулин вызывает усиление гликолиза, а продукты гликолиза (ацетил-КоА, НАДФН, ДАФ) являются исходными компонентами для синтеза жирных кислот и жиров.
источник
Основная роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы в крови. Это достигается регуляцией между синтезом и распадом гликогена, депонируемого в печени.
Влияние инсулина, глюкагона и адреналина на обмен жиров и углеводов.
Основное действие инсулина заключается в снижении концентрации глюкозы в крови. Инсулин увеличивает проницаемость плазматических мембран для глюкозы, активирует ключевые ферменты гликолиза, стимулирует образование в печени и мышцах из глюкозы гликогена, усиливает синтез жиров и белков
Механизм действия глюкагона обусловлен его связыванием со специфическими глюкагоновыми рецепторами клеток печени. Это приводит к повышению опосредованной G-белком активности аденилатциклазы и увеличению образования цАМФ. Результатом является усиление катаболизма депонированного в печени гликогена (гликогенолиза)
Адреналин — катаболический гормон и влияет практически на все виды обмена веществ. Под его влиянием происходит повышение содержания глюкозы в крови и усиление тканевого обмена. Будучи контринсулярным гормоном и воздействуя на β2 адренорецепторы тканей и печени, адреналин усиливает глюконеогенез и гликогенолиз, тормозит синтез гликогена в печени и скелетных мышцах, усиливает захват и утилизацию глюкозы тканями, повышая активность гликолитических ферментов. Также адреналин усиливает липолиз (распад жиров) и тормозит синтез жиров
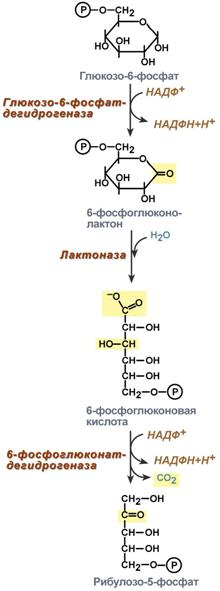
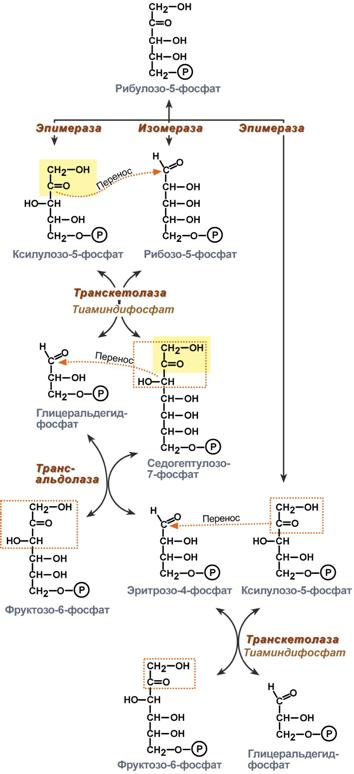
Роль пентозофосфатного пути обмена глюкозы для синтеза жиров
Глицеральдегид-3-фосфат в зависимости от условий и вида клеток может либо «проваливаться» во 2-й этап гликолиза либо через диоксиацетонфосфат восстанавливаться до глицерол-3-фосфата и далее направлятьяся в синтез триацилглицеролов.
Зависимость скорости биосинтеза жиров от ритма питания и состава пищи
После приема пищи концентрация хиломикронов в крови повышается, достигает максимума примерно через 5 ч, затем начинает снижаться.
Если во время приема пищи в печень поступает избыток глюкозы, который не используется для синтеза гликогена и других синтезов, то она превращается в липиды
Регуляция обмена жиров тесно сопряжена с регуляцией обмена глюкозы. Как и в случае обмена глюкозы, в регуляции обмена жиров важную роль играют гормоны инсулин, глюкагон, адреналин и процессы переключения фосфорилирования-дефосфори-лирования белков.
Напомним, что в печени после приема пищи ускоряется аэробный гликолиз и образование ацетил-КоА и оксалоацетата, а из них — цитрата (рис. 10.22; см. также рис. 10.5). Повышение концентрации цитрата активирует цикл переноса ацетильных остатков в цитозоль. В цитозоле в результате активации ацетил-КоА-карбоксилазы путем дефосфорилирования (см. рис. 10.10) ускоряется синтез жирных кислот. Одновременно стимулируется образование НАДФН в результате реакции малат -» пируват, а также в результате активации пентозофосфатного пути (инсулин индуцирует синтез глюкозо-6-фосфатдегидрогеназы). Жирные кислоты и глицерол-3-фосфат, образующийся тоже из глюкозы, превращаются в жиры, которые в печени упаковываются в ЛОНП и секретируются в кровь, а в жировой ткани пополняют запасы жира в адипоцитах. Таким образом в печени и в жировой ткани при пищеварении одновременно активируются гликолиз и синтез жиров из глюкозы. Перенос ацил-КоА в митохондрии не происходит вследствие высокой концентрации малонил-КоА, который ингибирует карни-тин-ацилтрансферазу (см. рис. 10.22); следовательно, не происходит и [3-окис-ление жирных кислот.
Механизмов, способных осуществлять синтез глюкозы из жирных кислот, у животных нет, но у растений такие механизмы имеются.
Синтез происходит только из глицерина.
Строение кетоновых тел
Кетоацидозразвивается при уменьшении концентрации инсулина крови, существенном недостатке углеводов в пище при достаточном или избыточном потреблении белков и жиров, при отравлении алкоголем, при голодании.
Механизм развития кетоацидоза состоит в избыточном окислении жирных кислот, поступающих в печень с пищей или из жировой ткани (активация липолиза) либо недостаточно эффективное сжигание «алкогольного» ацетил-SКоА.
Кетонемия (повышение концентрации кетоновых тел в крови) возникает при нарушении равновесия — скорость синтеза кетоновых тел превышает скорость их утилизации периферическими тканями организма.
Кетонурия Повышенное выведение кетоновых тел с мочой; наблюдается при сахарном диабете, отравлениях ацетоном, голодании
Диабетический кетоацидоз (ДКА) обусловливается резкой недостаточностью регуляторного действия инсулина на обмен глюкозы и жира. При ДКА к эффектам высокой гипергликемии добавляются последствия увеличения печеночного синтеза и поступления в кровь кетоновых тел, так что количество их намного превышает потребность периферических тканей в энергии. Основные кетоновые тела — ацетоуксусная и Р-гидроксимасляная кислоты — являются сильными органическими кислотами; гиперкетонемия вызывает метаболический ацидоз с последующей дыхательной компенсацией, а резкое повышение экскреции с мочой ацетоуксусной и бета-гидроксимасляной кислот неизбежно приводит к дополнительным потерям Na и К.. В результате спонтанного декарбоксилирования ацетоуксусной кислоты в плазме накапливается ацетон, который медленно выводится из организма через дыхательные пути.
Уровень свободных жирных кислот в плазме и их поступление в печень резко увеличиваются. В норме инсулин регулирует окисление свободных жирных кислот и кетогенез в печени за счет непрямого торможения транспорта КоА-производных длинноцепочечных жирных кислот через внутреннюю мембрану митохондрий в их матрикс. Эти производные, попав в митохондриальный матрикс, быстро окисляются, а повышение скорости их окисления в печени сверх определенного предела автоматически приводит к увеличению и высвобождению ацетоуксусной кислоты; большая, но непостоянная часть последней перед выходом в плазму восстанавливается до бета-гидроксимасляной кислоты. Глюкагон стимулирует транспорт ацил-КоА-производных длинноцепочечных жирных кислот и их окисление и кетогенез в митохондриях печени, а нормальный противодействующий эффект инсулина при ДКА отсутствует. Соотношение p-гидроксимасляной и ацетоуксусной кислот, в норме составляющее 3:1, при ДКА резко возрастает, достигая иногда 8:1.
Последнее изменение этой страницы: 2016-08-16; Нарушение авторского права страницы
источник
Печень участвует во всех этапах липидного обмена, начиная с переваривания липидов и заканчивая специфическими метаболическими превращениями отдельных липидных фракций:
· синтез желчных кислот и образование желчи;
· образование кетоновых тел;
· распад и синтез фосфолипидов;
· синтез холестерола и образование его эфиров; соотношение эфиры холестерина/свободный холестерин в норме составляет примерно 0,5 – 0,7 %; снижение этого коэффициента до 0,3 – 0,4 % наблюдается при поражениях печени и является неблагоприятным признаком;
· основное место синтеза липопротеинов очень низкой плотности и липопротеинов высокой плотности;
· гидроксилирование витамина D по 25-му положению.
Синтез жиров происходит в абсорбтивный период в печени и жировой ткани. Непосредственными субстратами в синтезе жиров являются ацил-КоА и глицерол-3-фосфат. Метаболический путь синтеза жиров в печени и жировой ткани одинаков, за исключением разных путей образования глицерол-3-фосфата.
Образование глицерол-3-фосфата Синтез жиров в печени и жировой ткани идёт через образование промежуточного продукта — фосфатидной кислоты. Предшественник фосфатидной кислоты — глицерол-3-фосфат, образующийся в печени двумя путями: восстановлением дигидроксиацетонфосфата — промежуточного метаболита гликолиза; фосфорилированием глицеролкиназой свободного глицерола, поступающего в печень из крови (продукт действия ЛП-липазы на жиры ХМ и ЛПОНП).
Печень — основной орган, где идёт синтез жирных кислот из продуктов гликолиза. В гладком ЭР гепатоцитов жирные кислоты активируются и сразу же используются для синтеза жиров, взаимодействуя с глицерол-3-фосфатом. Как и в жировой ткани, синтез жиров идёт через образование фосфатидной кислоты. Синтезированные в печени жиры упаковываются в ЛПОНП и сек-ретируются в кровь.Липопротеины очень низкой плотности (ЛПОНП) — образуются в печени
Биологическая роль: транспорт эндогенного жира, синтезированного в печени из избытка углеводов, в жировую ткань
эндогенные триацилглицерины 55%
\эфиры холестерина и холестерина – 17%
белковая часть -10%, представлена апоВ100
Из печени ЛПОНП поступают в кровь, где к ним присоединяются белки апо ЕиапоС
АпоС — активатор липопротеинлипазы капилляров, которая расщепляет триглицериды, образуя глицерин и жирные кислоты, поступающие в ткань
Липопротеины Высокой Плотности (ЛПВП) — образуются в печени
Биологическая роль: транспорт холестерина из тканей в печень и фосфолипидов из печени в ткани, то есть удаление холестерина из тканей
эндогенные триацилглицерины 3%
эфиры холестерина и холестерина – 20%
В кровеносном русле к ЛПВП присоединяется белок-фермент лецитинхолестеринацилтрансфераза (ЛХАТ).
13. Жировая инфильтрация печени. Причины развития. Понятие о липотропных факторах и механизмах их действия.Жировая инфильтрация печени:
Увеличение поступления жира в печень:
Перегрузка печени пищевым жиром и углеводами
Обеднение печени гликогеном, приводящее к мобилизации жира из депо
Повышение секреции соматотропного гормона гипофизом, мобилизующего жир из депо
Затруднение удаления (выхода) жира из печени:
Недостаточность синтеза специализированных белков для формирования транспортной формы ЛПОНП
Преобладание из двух конкурентных путей синтеза липидов (ТГ и ФЛ) именно триглицеридов в связи с недостаточностью липотропных факторов
Механизм развития жировой инфильтрации печени связан с недостаточным синтезом фосфатидилхолинов и сфингомиелинов, необходимых для формирования в этом органе ЛП. На образование последних, наряду с ФЛ, используются значительные количества триацилглицеролов и холестерола. Сформированные в печени ЛП, в частности богатые триацилглицеролами ЛПОНП, поступают в кровяное русло. Поэтому недостаточный синтез в печени содержащих холин ФЛ нарушает образование ЛП и ведет к накоплению в этом органе ТАГ и ХС. По этой причине холин, метионин, а также фосфатидилхолин относятся к группе липотропных веществ, прием которых с пищей предотвращает развитие жировой инфильтрации печени. К липотропам также относятся витамины В12, Вс, В6, карнитин.
14. Участие печени в обмене углеводов.Основная роль печени в углеводном обмене заключается в поддержании нормального содержания глюкозы в крови – т. е. в регуляции нормогликемии. Это достигается за счет нескольких механизмов.
1. Наличие в печени фермента глюкокиназы. Глюкокиназа, подобно гексокиназе, фосфорилирует глюкозу до глюкозо-6-фосфата. Следует отметить, что глюкокиназа в отличие от гексокиназы, содержится, только в печени и β-клетках островков Лангерганса. Активность глюкокиназы в печени в 10 раз превышает активность гексокиназы. Кроме того, глюкокиназа в противоположность гексокиназе имеет более высокое значение Кm для глюкозы (т. е. меньшее сродство к глюкозе).
После приема пищи содержание глюкозы в воротной вене резко возрастает и достигает 10 ммоль/л и более. Повышение концентрации глюкозы в печени вызывает существенное увеличение активности глюкокиназы и увеличивает поглощение глюкозы печенью. Благодаря синхронной работе гексокиназы и глюкокиназы печень быстро и эффективно фосфорилирует глюкозу до глюкозо-6-фосфата, обеспечивая нормогликемию в системе общего кровотока. Далее глюкозо-6-фосфат может метаболизироваться по нескольким направлениям (рис. 28.1).
| Гликоген |
| Глюкоза |
| Глюкозо-6- Фосфат |
| Пируват |
| Пентозофосфаты |
| ПФП |
Рис. 28.1. Участие глюкозо-6-фосфата в метаболизме углеводов
2. Синтез и распад гликогена. Гликоген печени выполняет роль депо глюкозы в организме. После приема пищи избыток углеводов откладывается в печени в виде гликогена, уровень которого составляет примерно 6 % от массы печени (100-150 г). В промежутках между приемами пищи, а также в период «ночного голодания» пополнения пула глюкозы в крови за счет всасывания из кишечника не происходит. В этих условиях активируется распад гликогена до глюкозы, что поддерживает уровень гликемии. Запасы гликогена истощаются к концу 1-х суток голодания.
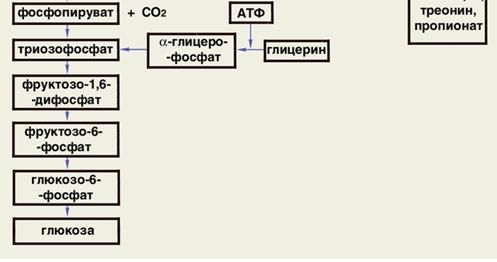
3. В печени активно протекает глюконеогенез – синтез глюкозы из неуглеводных предшественников (лактат, пируват, глицерол, гликогенные аминокислоты). Благодаря глюконеогенезу в организме взрослого человека образуется примерно 70 г глюкозы в сутки. Активность глюконеогенеза резко возрастает при голодании на 2-е сутки, когда запасы гликогена в печени исчерпаны.
Благодаря глюконеогенезу печень участвует в цикле Кори – процессе превращения молочной кислоты, образующейся в мышцах, в глюкозу.
4. В печени осуществляется превращение фруктозы и галактозы в глюкозу.
источник
Печень в организме человека выполняет целый ряд разнообразных и жизненно важных функций. Печень участвует практически во всех видах обмена: белковом, липидном, углеводном, водно-минеральном, пигментном.
Важнейшее значение печени в обмене веществ в первую очередь определяется тем, что она является как бы большой промежуточной станцией между портальным и общим кругом кровообращения. В печень человека более 70% крови поступает через воротную вену, остальная кровь попадает через печеночную артерию. Кровь воротной вены омывает всасывающую поверхность кишечника, и в результате большая часть веществ, всасывающихся в кишечнике, проходит через печень (кроме липидов, транспорт которых в основном осуществляется через лимфатическую систему). Таким образом, печень функционирует как первичный регулятор содержания в крови веществ, поступающих в организм с пищей.
Доказательством справедливости данного положения является следующий общий факт: несмотря на то что всасывание питательных веществ из кишечника в кровь происходит прерывисто, непостоянно, в связи с чем в портальном круге кровообращения могут наблюдаться изменения концентрации ряда веществ (глюкоза, аминокислоты и др.), в общем круге кровообращения изменения в концентрации указанных соединений незначительны. Все это подтверждает важную роль печени в поддержании постоянства внутренней среды организма.
Печень выполняет также крайне важную экскреторную функцию, теснейшим образом связанную с ее детоксикационной функцией. В целом без преувеличения можно констатировать, что в организме нет путей обмена веществ, которые прямо или косвенно не контролировались бы печенью, в связи с чем многие важнейшие функции печени уже рассматривались в соответствующих главах учебника. В данной главе будет сделана попытка дать обобщающие представления о роли печени в обмене веществ целостного организма.
ХИМИЧЕСКИЙ СОСТАВ ПЕЧЕНИ
У взрослого здорового человека масса печени составляет в среднем 1,5 кг. Некоторые исследователи считают, что эту величину следует рассматривать как нижнюю границу нормы, а диапазон колебаний от 20 до 60 г на 1 кг массы тела. В табл. представлены некоторые данные о химическом составе печени в норме. Из данных табл. видно, что более 70% от массы печени составляет вода. Однако следует помнить, что масса печени и ее состав подвержены значительным колебаниям как в норме, так и особенно при патологических состояниях.
Например, при отеках количество воды может составлять до 80% от массы печени, а при избыточном отложении жира в печени – снизиться до 55%. Более половины сухого остатка печени приходится на долю белков, причем примерно 90% из них – на глобулины. Печень богата различными ферментами. Около 5% от массы печени составляют липиды: нейтральные жиры (триглицериды), фосфолипиды, холестерин и др. При выраженном ожирении содержание липидов может достигать 20% от массы органа, а при жировом перерождении печени количество липидов может составлять 50% от сырой массы.
В печени может содержаться 150–200 г гликогена. Как правило, при тяжелых паренхиматозных поражениях печени количество гликогена в ней уменьшается. Напротив, при некоторых гликогенозах содержание гликогена достигает 20% и более от массы печени.
Разнообразен и минеральный состав печени. Количество железа, меди, марганца, никеля и некоторых других элементов превышает их содержание в других органах и тканях.
ПЕЧЕНЬ В УГЛЕВОДНОМ ОБМЕНЕ
Основная роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы в крови. Это достигается регуляцией между синтезом и распадом гликогена, депонируемого в печени.
Участие печени в поддержании концентрации глюкозы в крови определяется тем, что в ней протекают процессы гликогенеза, гликогенолиза, гликолиза и глюконеогенеза. Эти процессы регулируются многими гормонами, в том числе инсулином, глюкагоном, СТГ, глюкокортикоидами и катехоламинами. Поступающая в кровь глюкоза быстро захватывается печенью. Считают, что это обусловлено исключительно высокой чувствительностью гепатоцитов к инсулину (хотя есть данные, заставляющие усомниться в важности этого механизма).
При голодании снижается уровень инсулина и повышаются уровни глюкагона и кортизола. В ответ на это в печени усиливаются гликогенолиз и глюконеогенез. Для глюконеогенеза необходимы аминокислоты, особенно аланин, которые образуются при распаде мышечных белков. Напротив, после приема пищи аланин и разветвленные аминокислоты поступают из печени в мышцы, где участвуют в синтезе белков. Этот глюкозо-аланиновый цикл регулируется изменениями сывороточных концентраций инсулина, глюкагона и кортизола.
Предполагалось, что после приема пищи гликоген и жирные кислоты синтезируются прямо из глюкозы. Однако на самом деле эти превращения происходят непрямым путем с участием трикарбоновых метаболитов глюкозы (например, лактата ) или других субстратов глюконеогенеза, таких, как фруктоза и аланин.
При циррозе печени часто изменяется уровень глюкозы в крови. Обычно наблюдаются гипергликемия и нарушение толерантности к глюкозе. При этом активность инсулина в крови нормальна или повышена (за исключением гемохроматоза); следовательно, нарушение толерантности к глюкозе обусловлено инсулинорезистентностью. Ее причиной может быть снижение числа функционирующих гепатоцитов.
Есть также данные, что при циррозе печени наблюдается рецепторная и пострецепторная инсулинорезистентность гепатоцитов. Кроме того, при портокавальном шунтировании уменьшается печеночная элиминация инсулина и глюкагона, поэтому концентрация этих гормонов повышается. Однако при гемохроматозе уровень инсулина может снижаться (вплоть до развития сахарного диабета ) из-за отложения железа в поджелудочной железе . При циррозе способность печени использовать лактат в реакциях глюконеогенеза снижается, в результате его концентрация в крови может возрасти.
Хотя гипогликемия наиболее часто возникает при молниеносном гепатите , она может развиться и на конечных стадиях цирроза печени — вследствие снижения запаса гликогена в печени, уменьшения реакции гепатоцитов на глюкагон, понижения способности печени синтезировать гликоген из-за обширного разрушения клеток. Это усугубляется тем, что количество гликогена в печени даже в норме ограничено (около 70 г), организму же необходимо постоянное поступление глюкозы (около 150 г/сут). Поэтому запасы гликогена в печени истощаются очень быстро (в норме — уже после первого дня голодания).
В печени синтез гликогена и его регуляция в основном аналогичны тем процессам, которые протекают в других органах и тканях, в частности в мышечной ткани. Синтез гликогена из глюкозы обеспечивает в норме временный резерв углеводов, необходимый для поддержания концентрации глюкозы в крови в тех случаях, если ее содержание значительно уменьшается (например, у человека это происходит при недостаточном поступлении углеводов с пищей или в период ночного «голодания»).
Необходимо подчеркнуть важную роль фермента глюкокиназы в процессе утилизации глюкозы печенью. Глюкокиназа, подобно гексокиназе, катализирует фосфорилирование глюкозы с образованием глюкозо-фосфата, при этом активность глюкокиназы в печени почти в 10 раз превышает активность гексокиназы. Важное различие между этими двумя ферментами заключается в том, что глюкокиназа в противоположность гексокиназе имеет высокое значение КМ для глюкозы и не ингибируется глюкозо-6-фосфатом.
После приема пищи содержание глюкозы в воротной вене резко возрастает: в тех же пределах увеличивается и ее внутрипеченочная концентрация. Повышение концентрации глюкозы в печени вызывает существенное увеличение активности глюкокиназы и автоматически увеличивает поглощение глюкозы печенью (образовавшийся глюкозо-6-фосфат либо затрачивается на синтез гликогена, либо расщепляется).
Считают, что основная роль печени – расщепление глюкозы – сводится прежде всего к запасанию метаболитов-предшественников, необходимых для биосинтеза жирных кислот и глицерина, и в меньшей степени к окислению ее до СО2 и Н2О. Синтезированные в печени триглицериды в норме выделяются в кровь в составе липопротеинов и транспортируются в жировую ткань для более «постоянного» хранения.
В реакциях пентозофосфатного пути в печени образуется НАДФН, используемый для восстановительных реакций в процессах синтеза жирных кислот, холестерина и других стероидов. Кроме того, при этом образуются пентозофосфаты, необходимые для синтеза нуклеиновых кислот.
Наряду с утилизацией глюкозы в печени происходит и ее образование. Непосредственным источником глюкозы в печени служит гликоген. Распад гликогена в печени происходит в основном фосфоролитическим путем. В регуляции скорости гликогенолиза в печени большое значение имеет система циклических нуклеотидов. Кроме того, глюкоза в печени образуется также в процессе глюконеогенеза.
Основными субстратами глюконеогенеза служат лактат, глицерин и аминокислоты. Принято считать, что почти все аминокислоты, за исключением лейцина, могут пополнять пул предшественников глюконеогенеза.
При оценке углеводной функции печени необходимо иметь в виду, что соотношение между процессами утилизации и образования глюкозы регулируется прежде всего нейрогуморальным путем при участии желез внутренней секреции.
Центральную роль в превращениях глюкозы и саморегуляции углеводного обмена в печени играет глюкозо-6-фосфат. Он резко тормозит фосфоролитическое расщепление гликогена, активирует ферментативный перенос глюкозы с уридиндифосфоглюкозы на молекулу синтезирующегося гликогена, является субстратом для дальнейших гликолитических превращений, а также окисления глюкозы, в том числе по пентозофосфатному пути. Наконец, расщепление глюкозо-6-фосфата фосфатазой обеспечивает поступление в кровь свободной глюкозы, доставляемой током крови во все органы и ткани (рис. 16.1).
Как отмечалось, наиболее мощным аллостерическим активатором фосфофруктокиназы-1 и ингибитором фруктозо-1,6-бисфосфатазы печени является фруктозо-2,6-бисфосфат (Ф-2,6-Р2). Повышение в гепатоцитах уровня Ф-2,6-Р2 способствует усилению гликолиза и уменьшению скорости глюконеогенеза. Ф-2,6-Р2 снижает ингибирующее действие АТФ на фосфо-фруктокиназу-1 и увеличивает сродство этого фермента к фруктозо-6-фосфату. При ингибировании фруктозо-1,6-бисфосфатазы Ф-2,6-Р2 возрастает значение КМ для фруктозо-1,6-бисфосфата.
Содержание Ф-2,6-Р2 в печени, сердце, скелетной мускулатуре и других тканях контролируется бифункциональным ферментом, который осуществляет синтез Ф-2,6-Р2 из фруктозо-6-фосфата и АТФ и гидролиз его до фруктозо-6-фосфата и Pi, т.е. фермент одновременно обладает и киназной, и бисфосфатазной активностью. Бифункциональный фермент (фосфофруктокиназа-2/фруктозо-2,6-бисфосфатаза), выделенный из печени крысы, состоит из двух идентичных субъединиц с мол. массой 55000, каждая из которых имеет два различных каталитических центра. Киназный домен при этом расположен на N-конце, а бисфосфатазный – на С-конце каждой из полипептидных цепей.
Известно также, что бифункциональный фермент печени является прекрасным субстратом для цАМФ-зависимой протеинкиназы А. Под действием про-теинкиназы А происходит фосфорилирование остатков серина в каждой из субъединиц бифункционального фермента, что приводит к снижению его киназной и повышению бисфосфатазной активности. Заметим, что в регуляции активности бифункционального фермента существенная роль принадлежит гормонам, в частности глюкагону.
При многих патологических состояниях, в частности при сахарном диабете, отмечаются существенные изменения в функционировании и регуляции системы Ф-2,6-Р2. Установлено, что при экспериментальном (стептозотоциновом) диабете у крыс на фоне резкого увеличения уровня глюкозы в крови и моче в гепатоцитах содержание Ф-2,6-Р2 снижено. Следовательно, снижается скорость гликолиза и усиливается глюконео-генез. Данный факт имеет свое объяснение.
Возникающие у крыс при диабете нарушения гормонального фона: увеличение концентрации глю-кагона и уменьшение содержания инсулина – обусловливают повышение концентрации цАМФ в ткани печени, усиление цАМФ-зависимого фосфорилирования бифункционального фермента, что в свою очередь приводит к снижению его киназной и повышению бисфосфатазной активности. Таков может быть механизм снижения уровня Ф-2,6-Р2 в гепатоцитах при экспериментальном диабете. По-видимому, существуют и другие механизмы, ведущие к снижению уровня Ф-2,6-Р2 в гепатоцитах при стрептозото-циновом диабете. Показано, что при экспериментальном диабете в ткани печени имеет место снижение активности глюкокиназы (возможно, и снижение количества данного фермента).
Это приводит к падению скорости фосфорилирования глюкозы, а затем к снижению содержания фруктозо-6-фосфата – субстрата бифункционального фермента. Наконец, в последние годы было показано, что при стрептозотоциновом диабете уменьшается количество мРНК бифункционального фермента в гепатоцитах и как следствие – снижается уровень Ф-2,6-Р2 в ткани печени, усиливается глюко-неогенез. Все это еще раз подтверждает положение, что Ф-2,6-Р2, являясь важным компонентом в цепи передачи гормонального сигнала, выступает в роли третичного посредника при действии гормонов, прежде всего на процессы гликолиза и глюконеогенеза.
Рассматривая промежуточный обмен углеводов в печени, необходимо также остановиться на превращениях фруктозы и галактозы. Поступающая в печень фруктоза может фосфорилироваться в положении 6 до фруктозо-6-фосфата под действием гексокиназы, обладающей относительной специфичностью и катализирующей фосфорилирование, кроме глюкозы и фруктозы, еще и маннозы. Однако в печени существует и другой путь: фруктоза способна фосфорилироваться при участии более специфического фермента – фруктокиназы. В результате образуется фруктозо-1-фосфат.
Эта реакция не блокируется глюкозой. Далее фруктозо-1-фосфат под действием альдолазы расщепляется на две триозы: диоксиацетонфосфат и глицераль-дегид. Под влиянием соответствующей киназы (триокиназы) и при участии АТФ глицеральдегид подвергается фосфорилированию до глицеральдегид-3-фосфата. Последний (в него легко переходит и диоксиацетонфосфат) подвергается обычным превращениям, в том числе с образованием в качестве промежуточного продукта пировиноградной кислоты.
Следует отметить, что при генетически обусловленной нетолерантности к фруктозе или недостаточной активности фруктозо-1,6-бисфосфатазы наблюдается индуцируемая фруктозой гипогликемия, возникающая вопреки наличию больших запасов гликогена. Вероятно, фруктозо-1-фосфат и фруктозо-1,6-бисфосфат ингибируют фосфорилазу печени по аллосте-рическому механизму.
Известно также, что метаболизм фруктозы по гликолитическому пути в печени происходит гораздо быстрее, чем метаболизм глюкозы. Для метаболизма глюкозы характерна стадия, катализируемая фосфофрукто-киназой-1. Как известно, на этой стадии осуществляется метаболический контроль скорости катаболизма глюкозы. Фруктоза минует эту стадию, что позволяет ей интенсифицировать в печени процессы метаболизма, ведущие к синтезу жирных кислот, их эстерификацию и секрецию липопротеинов очень низкой плотности; в результате может увеличиваться концентрация триглицеридов в плазме крови.
Галактоза в печени сначала фосфорилируется при участии АТФ и фермента галактокиназы с образованием галактозо-1-фосфата. Для га-лактокиназы печени плода и ребенка характерны значения КМ и Vмaкс, примерно в 5 раз превосходящие таковые у ферментов взрослого человека. Большая часть галактозо-1-фосфата в печени превращается в ходе реакции, катализируемой гексозо-1-фосфат-уридилилтрансферазой:
УДФ-глюкоза + Галактозо-1-фосфат –> УДФ-галактоза + Глюкозо-1-фосфат.
Это уникальная трансферазная реакция возвращения галактозы в основное русло углеводного метаболизма. Наследственная утрата гексозо-1-фосфат-уридилилтрансферазы приводит к галактоземии – заболеванию, для которого характерны умственная отсталость и катаракта хрусталика. В этом случае печень новорожденных теряет способность метаболизи-ровать D-галактозу, входящую в состав лактозы молока.
РОЛЬ ПЕЧЕНИ В ЛИПИДНОМ ОБМЕНЕ
Ферментные системы печени способны катализировать все реакции или значительное большинство реакций метаболизма липидов. Совокупность этих реакций лежит в основе таких процессов, как синтез высших жирных кислот, триглицеридов, фосфолипидов, холестерина и его эфиров, а также липолиз триглицеридов, окисление жирных кислот, образование ацетоновых (кетоновых) тел и т.д. Напомним, что ферментативные реакции синтеза триглицеридов в печени и жировой ткани сходны. Так, КоА-производные жирной кислоты с длинной цепью взаимодействуют с глицерол-3-фосфатом с образованием фосфатидной кислоты, которая затем гидролизуется до диглицерида.
Путем присоединения к последнему еще одной молекулы КоА-производного жирной кислоты образуется триглицерид. Синтезированные в печени три-глицериды либо остаются в печени, либо секретируются в кровь в форме липопротеинов. Секреция происходит с известной задержкой (у человека 1–3 ч). Задержка секреции, вероятно, соответствует времени, необходимому для образования липопротеинов. Основным местом образования плазменных пре-β-липопротеинов (липопротеины очень низкой плотности – ЛПОНП) и α-липопротеинов (липопротеины высокой плотности – ЛПВП) является печень.
Рассмотрим образование ЛПОНП. Согласно данным литературы, основной белок апопротеин В-100 (апо Б-100) липопротеинов синтезируется в рибосомах шероховатого эндоплазматического ретикулума гепатоцитов. В гладком эндоплазматическом ретикулуме, где синтезируются и липидные компоненты, происходит сборка ЛПОНП. Одним из основных стимулов образования ЛПОНП является повышение концентрации неэстерифици-рованных жирных кислот (НЭЖК). Последние либо поступают в печень с током крови, будучи связанными с альбумином, либо синтезируются непосредственно в печени. НЭЖК служат главным источником образования триглицеридов (ТГ). Информация о наличии НЭЖК и ТГ передается на мембранно-связанные рибосомы шероховатого эндоплазматического ретикулума, что в свою очередь является сигналом для синтеза белка (апо В-100).
Синтезированный белок внедряется в мембрану шероховатого ретикулума, и после взаимодействия с фосфолипидным бислоем от мембраны отделяется участок, состоящий из фосфолипидов (ФЛ) и белка, который и является предшественником ЛП-частицы. Далее белокфосфо-липидный комплекс поступает в гладкий эндоплазматический ретикулум, где взаимодействует с ТГ и эстерифицированным холестерином (ЭХС), в результате чего после соответствующих структурных перестроек формируются насцентные, т.е. незавершенные, частицы (н-ЛПОНП). Последние поступают через тубулярную сеть аппарата Гольджи в секреторные везикулы и в их составе доставляются к поверхности клетки, после чего очень низкой плотности (ЛПОНП) в печеночной клетке (по А.Н. Климову и Н.Г. Никульчевой).
Путем экзоцитоза выделяются в перисинусоидные пространства (пространства Диссе). Из последнего н-ЛПОНП поступают в просвет кровяного синусоида, где происходят перенос апопротеинов С из ЛПВП на н-ЛПОНП и достраивание последних (рис. 16.3). Установлено, что время синтеза апо В-100, образования липид-белковых комплексов и секреции готовых частиц ЛПОНП составляет 40 мин.
У человека основная масса β-липопротеинов (липопротеины низкой плотности – ЛПНП) образуется в плазме крови из ЛПОНП при действии липопротеинлипазы. В ходе этого процесса образуются сначала промежуточные короткоживущие липопротеины (Пр.ЛП), а затем формируются частицы, обедненные триглицеридами и обогащенные холестерином, т.е. ЛПНП.
При высоком содержании жирных кислот в плазме их поглощение печенью возрастает, усиливается синтез триглицеридов, а также окисление жирных кислот, что может привести к повышенному образованию кетоновых тел.
Следует подчеркнуть, что кетоновые тела образуются в печени в ходе так называемого β-гидрокси-β-метилглутарил-КоА пути. Однако существует мнение, что ацетоацетил-КоА, являющийся исходным соединением при кетогенезе, может образоваться как непосредственно в ходе β-окисле-ния жирных кислот, так и в результате конденсации ацетил-КоА [Марри Р. и др., 1993]. Из печени кетоновые тела током крови доставляются в ткани и органы (мышцы, почки, мозг и др.), где они быстро окисляются при участии соответствующих ферментов, т.е. по сравнению с другими тканями печень является исключением.
В печени происходит интенсивный распад фосфолипидов, а также их синтез. Помимо глицерина и жирных кислот, которые входят в состав нейтральных жиров, для синтеза фосфолипидов необходимы неорганические фосфаты и азотистые соединения, в частности холин, для синтеза фосфатидхолина. Неорганические фосфаты в печени имеются в достаточном количестве. При недостаточном образовании или недостаточном поступлении в печень холина синтез фосфолипидов из компонентов нейтрального жира становится либо невозможным, либо резко снижается и нейтральный жир откладывается в печени. В этом случае говорят о жировой инфильтрации печени, которая может затем перейти в ее жировую дистрофию.
Иными словами, синтез фосфолипидов лимитируется количеством азотистых оснований, т.е. для синтеза фосфоглицеридов необходим либо холин, либо соединения, которые могут являться донорами метильных групп и участвовать в образовании холина (например, метионин). Такие соединения получили название липотропных веществ. Отсюда становится ясным, почему при жировой инфильтрации печени весьма полезен творог, содержащий белок казеин, в составе которого имеется большое количество остатков аминокислоты метионина.
Рассмотрим роль печени в обмене стероидов, в частности холестерина. Часть холестерина поступает в организм с пищей, но значительно большее количество его синтезируется в печени из ацетил-КоА. Биосинтез холестерина в печени подавляется экзогенным холестерином, т.е. получаемым с пищей.
Таким образом, биосинтез холестерина в печени регулируется по принципу отрицательной обратной связи. Чем больше холестерина поступает с пищей, тем меньше его синтезируется в печени, и наоборот. Принято считать, что действие экзогенного холестерина на биосинтез его в печени связано с торможением β-гидрокси-β-метилглутарил-КоА-редуктазной реакции:
Часть синтезированного в печени холестерина выделяется из организма вместе с желчью, другая часть превращается в желчные кислоты и используется в других органах для синтеза стероидных гормонов и иных соединений.
В печени холестерин может взаимодействовать с жирными кислотами (в виде ацил-КоА) с образованием эфиров холестерина. Синтезированные в печени эфиры холестерина поступают в кровь, в которой содержится также определенное количество свободного холестерина.
РОЛЬ ПЕЧЕНИ В ОБМЕНЕ БЕЛКОВ
Печень играет центральную роль в обмене белков.
Она выполняет следующие основные функции:
— синтез специфических белков плазмы;
— образование мочевины и мочевой кислоты;
— трансаминирование и дезаминирование аминокислот, что весьма важно для взаимных превращений аминокислот, а также для процесса глюконеогенеза и образования кетоновых тел.
Все альбумины плазмы, 75–90% α-глобу-линов и 50% β-глобулинов синтезируются гепатоцитами. Лишь γ-гло-булины продуцируются не гепатоцитами, а системой макрофагов, к которой относятся звездчатые ретикулоэндотелиоциты (клетки Купфера). В основном γ-глобулины образуются в печени. Печень является единственным органом, где синтезируются такие важные для организма белки, как протромбин, фибриноген, проконвертин и проакцелерин.
При заболеваниях печени определение фракционного состава белков плазмы (или сыворотки) крови нередко представляет интерес как в диагностическом, так и в прогностическом плане. Известно, что патологический процесс в гепатоцитах резко снижает их синтетические возможности. В результате содержание альбумина в плазме крови резко падает, что может привести к снижению онкотического давления плазмы крови, развитию отеков, а затем асцита. Отмечено, что при циррозах печени, протекающих с явлениями асцита, содержание альбуминов в сыворотке крови на 20% ниже, чем при циррозах без асцита.
Нарушение синтеза ряда белковых факторов системы свертывания крови при тяжелых заболеваниях печени может привести к геморрагическим явлениям.
При поражениях печени нарушается также процесс дезаминирования аминокислот, что способствует увеличению их концентрации в крови и моче. Так, если в норме содержание азота аминокислот в сыворотке крови составляет примерно 2,9–4,3 ммоль/л, то при тяжелых заболеваниях печени (атрофические процессы) эта величина возрастает до 21 ммоль/л, что приводит к аминоацидурии. Например, при острой атрофии печени количество тирозина в суточном количестве мочи может достигать 2 г (при норме 0,02–0,05 г/сут).
В организме образование мочевины в основном происходит в печени. Синтез мочевины связан с затратой довольно значительного количества энергии (на образование 1 молекулы мочевины расходуется 3 молекулы АТФ). При заболевании печени, когда количество АТФ в гепатоцитах уменьшено, синтез мочевины нарушается. Показательно в этих случаях определение в сыворотке отношения азота мочевины к аминоазоту. В норме это отношение равно 2:1, а при тяжелом поражении печени составляет 1:1.
Большая часть мочевой кислоты также образуется в печени, где много фермента ксантиноксидазы, при участии которого оксипурины (гипо-ксантин и ксантин) превращаются в мочевую кислоту. Нельзя забывать о роли печени и в синтезе креатина. Имеются два источника креатина в организме. Существует экзогенный креатин, т.е. креатин пищевых продуктов (мясо, печень и др.), и эндогенный креатин, синтезирующийся в тканях. Синтез креатина происходит в основном в печени, откуда он с током крови поступает в мышечную ткань. Здесь креатин, фосфори-лируясь, превращается в креатинфосфат, а из последнего образуется креатин.
Желчь – жидкий секрет желтовато-коричневого цвета, отделяется печеночными клетками. В сутки у человека образуется 500–700 мл желчи (10 мл на 1 кг массы тела). Желчеобразование происходит непрерывно, хотя интенсивность этого процесса на протяжении суток резко колеблется. Вне пищеварения печеночная желчь переходит в желчный пузырь, где происходит ее сгущение в результате всасывания воды и электролитов. Относительная плотность печеночной желчи 1,01, а пузырной – 1,04. Концентрация основных компонентов в пузырной желчи в 5–10 раз выше, чем в печеночной.
Предполагают, что образование желчи начинается с активной секреции гепатоцитами воды, желчных кислот и билирубина, в результате которой в желчных канальцах появляется так называемая первичная желчь. Последняя, проходя по желчным ходам, вступает в контакт с плазмой крови, вследствие чего между желчью и плазмой устанавливается равновесие электролитов, т.е. в образовании желчи принимают участие в основном два механизма – фильтрация и секреция.
В печеночной желчи можно выделить две группы веществ. Первая группа – это вещества, которые присутствуют в желчи в количествах, мало отличающихся от их концентрации в плазме крови (например, ионы Na+, К+, креатин и др.), что в какой-то мере служит доказательством наличия фильтрационного механизма. Ко второй группе относятся соединения, концентрация которых в печеночной желчи во много раз превышает их содержание в плазме крови (билирубин, желчные кислоты и др.), что свидетельствует о наличии секреторного механизма. В последнее время появляется все больше данных о преимущественной роли активной секреции в механизме желчеобразования. Кроме того, в желчи обнаружен ряд ферментов, из которых особо следует отметить щелочную фосфатазу печеночного происхождения. При нарушении оттока желчи активность данного фермента в сыворотке крови возрастает.
Основные функции желчи. Эмульсификация. Соли желчных кислот обладают способностью значительно уменьшать поверхностное натяжение. Благодаря этому они осуществляют эмульгирование жиров в кишечнике, растворяют жирные кислоты и нерастворимые в воде мыла. Нейтрализация кислоты. Желчь, рН которой немногим более 7,0, нейтрализует кислый химус, поступающий из желудка, подготавливая его для переваривания в кишечнике. Экскреция. Желчь – важный носитель экскрети-руемых желчных кислот и холестерина. Кроме того, она удаляет из организма многие лекарственные вещества, токсины, желчные пигменты и различные неорганические вещества, такие, как медь, цинк и ртуть. Растворение холестерина. Как отмечалось, холестерин, подобно высшим жирным кислотам, представляет собой нерастворимое в воде соединение, которое сохраняется в желчи в растворенном состоянии лишь благодаря присутствию в ней солей желчных кислот и фосфатидилхолина.
При недостатке желчных кислот холестерин выпадает в осадок, при этом могут образовываться камни. Обычно камни имеют окрашенное желчным пигментом внутреннее ядро, состоящее из белка. Чаще всего встречаются камни, у которых ядро окружено чередующимися слоями холестерина и билирубината кальция. Такие камни содержат до 80% холестерина. Интенсивное образование камней отмечается при застое желчи и наличии инфекции. При застое желчи встречаются камни, содержащие 90–95% холестерина, а при инфекции могут образовываться камни, состоящие из билирубината кальция. Принято считать, что присутствие бактерий сопровождается увеличением β-глюкуронидазной активности желчи, что приводит к расщеплению конъюгатов билирубина; освобождающийся билирубин служит субстратом для образования камней.
Не нашли то, что искали? Воспользуйтесь поиском:
источник