Кость Широкая решила рассказать вам все самое важное и нужное о гликогене, чтобы больше не верили в миф о том, что «сжигание жиров начинается только после 20 минуты бега». Заинтриговали?
Итак, из этой статьи вы узнаете: что такое гликоген, строение и биологическую роль, его свойства, а также формулу и структуру строения, где и для чего содержится гликоген, как происходит синтез и распад вещества, как происходит обмен, а также, какие продукты являются источником гликогена.
Нашему телу еда в первую очередь нужна как источник энергии, а уже потом, как источник удовольствия, антистрессовый щит или возможность «побаловать» себя. Как известно, энергию мы получаем из макронутриентов: жиров, белков и углеводов.
Жиры дают 9 ккал, а белки и углеводы — 4 ккал. Но не смотря на большую энергетическую ценность жиров и важную роль незаменимых аминокислот из белков важнейшими «поставщиками» энергии в наш организм являются углеводы.
Почему? Ответ прост: жиры и белки являются «медленной» формой энергии, т.к. на их ферментацию требуется определенное время, а углеводы — относительно «быстрой». Все углеводы (будь то конфета или хлеб с отрубями) в конце концов расщепляются до глюкозы, которая необходима для питания всех клеток организма.

Гликоген — это своеобразный «консервант» углеводов, другими словами, энергетические резервы организма — сохраненная про запас для последующих энергетических нужд глюкоза. Она хранится в связанном с водой состоянии. Т.е. гликоген — это «сироп» калорийностью 1-1.3 ккал/гр (при калорийности углеводов 4 ккал/г).
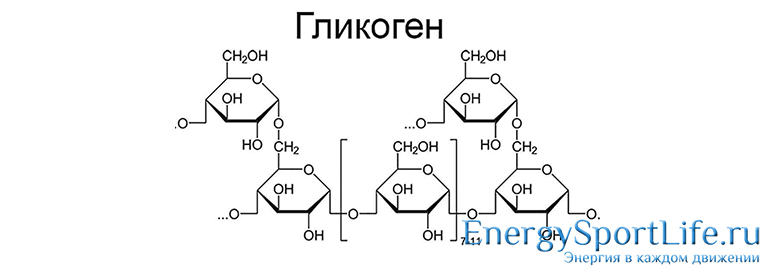
По сути, молекула гликогена состоит из остатков глюкозы, это запасное вещество на случай нехватки энергии в организме!
Структурная формула строения фрагмента макромолекулы гликогена (C6H10O5) выглядит схематично так:
Вообще, гликоген — это полисахарид, а значит, относится к классу «сложных» углеводов:
В гликоген может пойти только углевод. Поэтому крайне важно держать в своем рационе планку углеводов не ниже 50 % от общей калорийности. Употребляя нормальный уровень углеводов (около 60% от суточного рациона) вы по максимуму сохраняете собственный гликоген и заставляете организм очень хорошо окислять углеводы.
Важно иметь в рационе хлебобулочные изделия, каши, злаки, разные фрукты и овощи.
Лучшими источниками гликогена являются: сахар, мед, шоколад, мармелад, варенье, финики, изюм, инжир, бананы, арбуз, хурма, сладкая выпечка.
Осторожно к подобной пище стоит отнестись лицам с дисфункцией печени и недостатком ферментов.
Как же происходит создание и процесс распад гликогена?
Как организм запасает гликоген? Процесс образования гликогена (гликогенез) проходит по 2 сценариям. Первый — это процесс запаса гликогена. После углеводосодержащей еды уровень глюкозы в крови повышается. В ответ инсулин попадает в кровоток, чтобы впоследствии облегчить доставку глюкозы в клетки и помочь синтезу гликогена.
Благодаря ферменту (амилазе) происходит расщепление углеводов (крахмала, фруктозы, мальтозы, сахарозы) на более мелкие молекулы.
Затем под воздействием ферментов тонкого кишечника осуществляется распад глюкозы на моносахариды. Значительная часть моносахаридов (самая простая форма сахара) поступает в печень и мышцы, где гликоген откладывается в «резерв». Всего синтезируется 300-400 гр гликогена.
Т.е. само превращение глюкозы в гликоген (запасной углевод) происходит в печени, т.к. мембраны клеток печени в отличие от мембраны клеток жировой ткани и мышечных волокон свободно проницаемы для глюкозы и в отсутствие инсулина.
Второй механизм под названием мобилизация (или распад) запускается в периоды голода или активной физической деятельности. По мере необходимости гликоген мобилизуется из депо и превращается в глюкозу, которая поступает к тканям и используется ими в процессе жизнедеятельности.
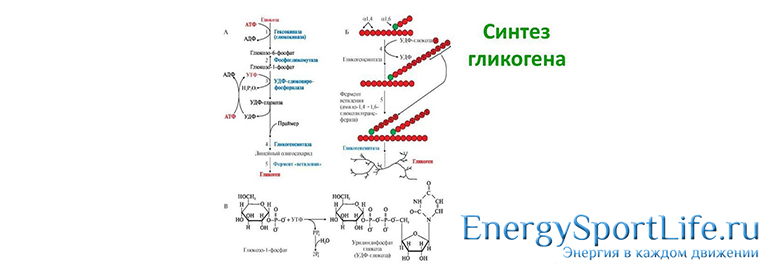
Когда организм истощает запас гликогена в клетках, то мозг подает сигналы о необходимости «дозаправки». Схема синтеза и мобилизации гликогена:
Кстати, при распаде гликогена происходит торможение его синтеза, и наоборот: при активном образовании гликогена его мобилизация тормозится. Гормоны, отвечающие за мобилизацию данного вещества, т.е., гормоны, стимулирующие распад гликогена — это адреналин и глюкагон.
Где накапливается гликоген для последующего использования:
Основные запасы гликогена находятся в печени и мышцах. Количество гликогена в печени может достигать у взрослого человека 150 — 200 гр. Клетки печени являются лидерами по накоплению гликогена: они могут на 8 % состоять из этого вещества.
Основная функция гликогена печени — поддержать уровень сахара в крови на постоянном, здоровом уровне.
Печень сама себе является одним из важнейших органов организма (если вообще стоит проводить «хит парад» среди органов, которые нам все необходимы), а хранение и использование гликогена делает ее функции еще ответственнее: качественное функционирование головного мозга возможно только благодаря нормальному уровню сахара в организме.
Если же уровень сахара в крови снижается, то возникает дефицит энергии, из-за которого в организме начинается сбой. Нехватка питания для мозга сказывается на центральной нервной системе, которая истощается. Тут то и происходит расщепление гликогена. Потом глюкоза поступает в кровь, благодаря чему организм получает необходимое количество энергии.
Запомним также, что в печени происходит не только синтез гликогена из глюкозы, но и обратный процесс — гидролиз гликогена до глюкозы. Этот процесс вызывается понижением концентрации сахара в крови в результате усвоения глюкозы различными тканями и органами.
Гликоген откладывается также в мышцах. Общее количество гликогена в организме составляет 300 — 400 граммов. Как мы знаем, около 100-120 граммов вещества накапливается в клетках печени, а вот остальная часть (200-280 гр) сохраняется в мышцах и составляет максимум 1 — 2% от общей массы этих тканей.
Хотя если говорить максимально точно, то следует отметить, что гликоген хранится не в мышечных волокнах, а в саркоплазме — питательной жидкости, окружающей мышцы.
Количество гликогена в мышцах увеличивается в случае обильного питания и уменьшается во время голодания, а снижается только во время физической нагрузки – длительной и/или напряженной.
При работе мышц под влиянием специального фермента фосфорилазы, которая активируется в начале мышечного сокращения, происходит усиленное распад гликогена в мышцах, который используется для обеспечения глюкозой работы самих мышц (мышечных сокращений). Таким образом, мышцы используют гликоген только для собственных нужд.
Интенсивная мышечная деятельность замедляет всасывание углеводов, а легкая и непродолжительная работа усиливает всасывание глюкозы.
Гликоген печени и мышц используется для разных нужд, однако говорить о том, что какой-то из них важнее — абсолютнейший вздор и демонстрирует только вашу дикую неграмотность.

Все, что написано на данном скрине, полная ересь. Если вы боитесь фруктов и думаете, что они прямиком запасаются в жир, то никому не говорите этой чуши и срочно читайте статью Фруктоза: можно ли есть фрукты и худеть?
Важно знать, почему работают низкоуглеводные высокобелковые диеты. В организме взрослого может находиться около 400 граммов гликогена, а как мы помним, на каждый грамм резервной глюкозы приходится примерно 4 грамма воды.
Т.е. около 2 кг вашего веса — это масса гликогенного водного раствора. Кстати, поэтому мы активно потеем в процессе тренировок — организм расщепляет гликоген и при этом теряет в 4 раза больше жидкости.
Этим свойством гликогена объясняется и быстрый результат экспресс-диет для похудения. Безуглеводные диеты провоцируют интенсивное израсходование гликогена, а с ним – жидкости из организма. Но как только человек возвращается к обычному рациону с содержанием углеводов, запасы животного крахмала восстанавливаются, а с ними и потерянная за период диеты жидкость. В этом и кроется причина недолгосрочности результата экспресс-похудения.
Для любых активных физических нагрузок (силовые упражнения в тренажерном зале, бокс, бег, аэробика, плавание и все, что заставляет вас потеть и напрягаться) организму нужно 100-150 граммов гликогена в каждый час активности. Потратив запасы гликогена, тело начинает разрушать сперва мышцы, затем жировую ткань.
Обратите внимание: если речь идет не о длительном полном голодании, запасы гликогена не истощаются полностью, потому что имеют жизненно важное значение. Без запасов в печени мозг может остаться без снабжения глюкозой, а это смертельно опасно, ведь мозг самый главный орган (а не попа, как некоторые думают).
Без запасов в мышцах сложно совершить интенсивную физическую работу, что в природе воспринимается как повышенный шанс быть съеденным/без потомства/замерзшим и т.д.
Тренировки истощают запасы гликогена, но не по схеме «первые 20 минут работаем на гликогене, потом переходим на жиры и худеем».
Для примера возьмем исследование, в котором тренированные атлеты выполняли 20 сетов упражнений на ноги (4 упражнения, 5 сетов каждого; каждый сет выполнялся до отказа и составлял 6-12 повторений; отдых был коротким; общее время тренировки составило 30 минут).
Кто знаком с силовыми тренировками, понимает, что было отнюдь не легко. До и после упражнения у них брали биопсию и смотрели содержание гликогена. Оказалось, что количество гликогена снизилось с 160 до 118 ммоль/кг, т. е. менее, чем на 30%.
Вот так походя мы развеяли еще один миф — вряд ли за тренировку вы успеете исчерпать все запасы гликогена, так что не стоит набрасываться на еду прямо в раздевалке среди потных кроссовок и посторонних тел, вы явно не помрете от «неминуемого» катаболизма.
Кстати, пополнять запасы гликогена стоит не в течении 30 минут после тренировки ( увы, белково-углеводное окно – миф ), а в течении 24 часов.
Люди крайне преувеличивают скорость истощения гликогена (как и многие другие вещи)! Любят сразу на тренировке закинуться «углями» после первого разминочного подхода с грифом пустым, а то ж «истощение мышечного гликогена и КАТАБОЛИЗМ». Прилег на час днем и усе, печеночного гликогена как не бывало.
Мы уж молчим про катастрофические энергозатраты от 20минутного черепашьего бега. Да и вообще, мышцы жрут чуть не 40 ккал на 1 кг, белок гниет, образует слизь в жкт и провоцирует рак, молочка заливает так, что аж 5 лишних кило на весах (не жира, ага), жиры вызывают ожирение, углеводы смертельно опасны (боюсь-боюсь) и от глютена вы точно помрете.
Странно только, что мы вообще ухитрились выжить в доисторические времена и не вымерли, хотя питались явно не амброзией и спортпитом.
Помните, пожалуйста, что природа умнее нас и давно все при помощи эволюции отрегулировала. Человек один из самых адаптированных и приспосабливаемых организмов, который способен существовать, размножаться, выживать. Так что без психозов, господа и дамы.
Однако тренироваться на пустой желудок более чем бессмысленно.»Что же делать?» подумаете вы. Ответ вы узнаете в статье «Кардио: когда и зачем?» , которая расскажет вам о последствиях голодных тренировок.
Гликоген печени расщепляется при снижении концентрации глюкозы в крови, прежде всего между приемами пищи. Через 48-60 часов полного голодания запасы гликогена в печени полностью истощаются.
Гликоген мышц расходует во время физической активности. И тут мы опять вернемся к мифу: «Чтобы сжечь жир, нужно бегать не менее 30 минут, поскольку только на 20-й минуте в организме истощаются запасы гликогена и в качестве топлива начинает использоваться подкожный жир», только с чисто математической стороны. Откуда это пошло? А пес его знает!
Действительно, организму проще использовать гликоген, чем окислять жир для энергии, поэтому в первую очередь расходуется он. Отсюда и миф: надо сначала израсходовать ВЕСЬ гликоген, и потом жир начнет гореть, а произойдет это примерно через 20 минут после начала аэробной тренировки. Почему 20? Понятия не имеем.
НО: никто не учитывает, что использовать весь гликоген не так-то просто и 20-ю минутами тут дело не ограничится.
Как мы знаем, общее количество гликогена в организме составляет 300 — 400 граммов, а в некоторых источниках говорится о 500 граммах, что дает нам от 1200 до 2000 ккал! Вы вообще представляете, сколько нужно бегать, чтобы истощить такую прорву калорий? Человек весом в 60 кг должен будет пробежать в среднем темпе от 22 до З5 километров. Ну как, готовы?

источник
В мобилизации гликогена ключевую роль играет фосфоролитический распад. Фосфорилазы переводят полисахариды (в частности гликоген) из запасной формы в метаболически активную форму; в присутствии фосфорилазы гликоген распадается с образованием фосфорного эфира глюкозы (глюкозо-1-фосфата) без предварительного расщепления на более крупные части молекулы полисахарида. Большую роль в процессе образования глюкозо-1-фосфата играет аденилатциклазный механизм.
Образовавшийся глюкозо-1-фосфат превращается под действием фосфоглюкомутазы в глюкозо-6-фосфат. Для осуществления данной реакции необходима фосфорилированная форма фосфоглюкомутазы, т.е. ее активная форма, которая образуется, как уже указывалось, в присутствии глюкозо-1,6-бифосфата.
Образование свободной глюкозы из глюкозо-6-фосфата в печени происходит под влиянием глюкозо-6-фосфатазы, которая катализирует гидролитическое отщепление фосфата.


1 и 3 ферменты – ключевые. Фосфорилаза «а» активируется адреналином и глюкагоном. Смысл активирования заключается в фосфатной модификации ферментов. На каждом этапе происходит многократное усиление гормонального сигнала. Одна молекула адреналина способна отщепить от гликогена 40 млн. молекул глюкозы.
Рис. 3 Обшая схема путей распада и синтеза гликогена.
ф
Можно считать, что сохранение постоянства концентрации глюкозы в крови является резуль-татом одновременного протекания двух процессов: поступления глюкозы в кровь из печени и потребления ее из крови тканями,где она используется в первую очередь как энергети-ческий материал. В тканях (в том числе и в печени) существуют два основных пути распада глюкозы:
анаэробный (при отсутствии кислорода)
аэробный (для осуществления которого необходим кислород).
Гликолиз (от греч. Glycys — сладкий и lysis — растворение, распад) – сложный ферментативный процесс последовательных превращений глюкозы, протекающий в тканях человека и животных без потребления кислорода. Конечным продуктом гликолиза является молочная кислота. В процессе гликолиза образуется АТФ. Суммарное уравнение гликолиза можно изобразить следующим образом:
C
В анаэробных условиях гликолиз — единственный процесс в животном организме, поставляющий энергию. Именно благодаря процессу гликолиза организм человека и животных определенный период времени может осуществлять ряд физиологических функций в условиях недостаточности кислорода. В тех случаях, когда гликолиз протекает в присутствии кислорода, говорят об аэробном гликолизе.
Последовательность реакций гликолиза, также как и их промежуточные продукты, хорошо изучены. Процесс гликолиза катализируется одиннадцатью ферментами, большинство из которых выделено в гомогенном, кристаллическом или высокоочищенном виде, и свойства которых достаточно известны. Необходимо также заметить, что гликолиз протекает в гиалоплазме (цитозоле) клетки.
Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой:


Образование глюкозо-6-фосфата в гексокиназной реакции связано с освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.
Наиболее важным свойством фермента гексокиназы является ее ингибирование глюкозо-6-фосфатом, т.е. последний служит одновременно и продуктом реакции, и аллостерическим ингибитором.
Фермент гексокиназа способен катализировать фосфорилирование не только Б-глюкозы, но и других гексоз, в частности Б-фруктозы, Э-маннозы и др. В печени, кроме гексокиназы, существует фермент глюкокиназа, который катализирует фосфорилирование только Б-глюкозы. В мышечной ткани этот фермент отсутствует.
Второй реакцией гликолиза является превращение глюкозо-6-фосфата под действием фермента глюкозо-6-фосфат-изомеразы во фруктозо-6-фосфат:

Третья реакция катализируется ферментом фосфофруктокиназой, образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ:

Данная реакция аналогично гексокиназной практически необратима, протекает в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза. Фактически эта реакция определяет скорость гликолиза в целом. Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируется АМФ. При значительных величинах отношения АТФ/АМФ активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, внеработающей мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза.
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо-1,6-бифосфат расщепляется на две фосфотриозы.
Ф
Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. В целом же при повышении темпеатуры реакция сдвигается в сторону большего образования триозофосфатов (диоксиацетонфосфата и глицеральдегид-3-фосфата).
Пятая реакция — реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой.

C

C
Равновесие данной изомеразной реакции сдвинуто в сторону диоксиацетонфосфата: 95% диоксиацетонфосфата и около 5%глицеральдегид-3-фосфата. Однако в последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы.
Образованием глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза. Вторая стадия — наиболее сложная и важная. Она включает окислительно-восстановительную реакцию (реакцию гликолитической оксидоредукции), сопряженную с субстратным фосфорилированием, в процессе которого образуется АТФ.
В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-биофосфоглицериновой кислоты и восстановленной формы НАД (НАДН2). Эта реакция блокируется йод- или бромацетатом, протекает в несколько этапов. Суммарно данную реакцию можно изобразить в следующем виде.

C


H
1,3-бифосфоглицерат представляет собой высокоэнергетическое соединение (макроэргическая связь условно обозначена знаком «тильда»—). Механизм действия глицеральдегидфосфатдегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН2 глицеральдегид-3-фосфат связывается с молекулой фермента за счет 8Н-групп последнего. Образовавшаяся связь богата энергией, но она непрочна и расщепляется под влиянием неорганического фосфата. При этом образуется 1,3-бифосфоглицериновая кислота.
Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с образованием АТФ и 3-фосфоглицериновой кислоты (3-фосфоглицерата):

C


H
Таким образом, благодаря действию двух ферментов (глицеральдегидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ. В отличие от окислительного фосфорилирования образование АТФ из высокоэнергетических соединений называется субстратным фосфорилированием.
В восьмой реакции происходит внутримолекулярный перенос оставшейся фосфатной группы и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту. Реакция протекает в присутствии ионов Мg, легкообратима.
В девятой реакции 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту. При этом фосфатная связь в положении 2 становится высокоэнергетической. Фермент реакции — енолаза активируется двухвалентными катионами Мg или Мn и ингибируется фторидом.
Десятая реакция характеризуется разрывом высокоэнергетической связи и переносом фосфатного остатка фосфоенолпирувата на АДФ (субстратное фосфорилирование). Катализируется ферментом пируваткиназой:
C

C

Фосфоенолпируват Пировиноградная кислота
Для действия пируваткиназы необходимы ионы Мg, а также одновалентные катионы щелочных металлов (К + или др.) внутри клети, реакция является практически необратимой.
В результате одиннадцатой реакции происходит восстановление пировиноградной кислоты и образуется молочная кислота. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАДН2, образовавшегося в шестой реакции:
C
C

Фосфоенолпируват Молочная кислота
Реакция восстановления пирувата завершает внутренний окислительно-восстановительный цикл гликолиза. НАДH + при этом играет роль лишь промежуточного переносчика водорода от глицеральдегид-3-фосфата (шестая реакция) на пировиноградную кислоту (одиннадцатая реакция), при этом сам он регенерируется и вновь может участвовать в циклическом процессе, получившем название гликолитической оксидоредукции.
Биологическое значение процесса гликолиза прежде всего заключается в образовании богатых энергией фосфорных соединений. На первых стадиях гликолиза затрачиваются две молекулы АТФ (гексокиназая и фосфофруктокиназная реакции). На последующих образуются четыре молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции). Таким образом, энергетическая эффективность гликолиза в анаэробных условиях составляет две молекулы АТФ на одну молекулу глюкозы. Известно, что изменение свободной энергии при расщеплении глюкозы до двух молекул молочной кислоты составляет около 210 кДж/моль:

Из этого количества энергии около 126 кДж рассеивается в виде тепла, а 84 кДж (максимально) накапливается в форме богатых энергией фосфатных связей АТФ, так как макроэргическая связь в молекуле АТФ соответствует примерно 33,6-42,0 кДж/моль. Таким образом, коэффициент полезного действия анаэробного гликолиза близок к 0,4 (84/210).
Величины изменения свободной энергии точно определены для отдельных реакций гликолиза в интактных эритроцитах человека. Установлено, что восемь реакций гликолиза близки к равновесию, а три реакции (гексокиназная, фосфофруктокиназная, пируваткиназная) сопровождаются значительным уменьшением свободной энергии, т.е. практически являются необратимыми.
В целом последовательность протекающих при гликолизе реакций может быть представлена в следующем виде:
источник
Глюкоза является главным энергетическим материалом для функционирования человеческого тела. В организм она поступает с пищей в виде углеводов. На протяжении многих тысячелетий человек претерпевал массу эволюционных изменений.
Одним из важных приобретенных умений стала способность организма впрок запасать энергетические материалы на случай голода и синтезировать их из других соединений.
Избытки углеводов аккумулируются в организме при участии печени и сложных биохимических реакций. Все процессы накопления, синтеза и использования глюкозы регулируются гормонами.
Существуют следующие пути для использования глюкозы печенью:
- Гликолиз. Сложный многоступенчатый механизм окисления глюкозы без участия кислорода, в результате которого образуется универсальные источники энергии: АТФ и НАДФ — соединения, обеспечивающие энергией протекание всех биохимических и обменных процессов в организме;
- Запасание в виде гликогена при участии гормона инсулина. Гликоген – неактивная форма глюкозы, которая может накапливаться и сберегаться в организме;
- Липогенез. Если глюкозы поступает больше, чем необходимо даже для образования гликогена, начинается синтез липидов.
Роль печени в углеводном обмене огромна, благодаря ей в организме постоянно присутствует запас углеводов, жизненно необходимых организму.
Основная роль печени — регуляция углеводного обмена и глюкозы с последующим депонированием гликогена в гепатоцитах человека. Особенностью является превращение сахара под воздействием узкоспециальных ферментов и гормонов в особую его форму, этот процесс происходит исключительно в печени (необходимое условие потребления её клетками). Эти преобразования ускоряются ферментами гексо- и глюкокиназой при понижении уровня содержания сахара.
В процессе пищеварения (а углеводы начинают расщепляться сразу после попадания еды в ротовую полость) содержание глюкозы в крови повышается, вследствие чего происходит ускорение реакций, направленных на депонирование излишков. Тем самым предупреждается возникновение гипергликемии во время приёма пищи.
Сахар из крови с помощью ряда биохимических реакций в печени преобразуется в неактивное его соединение – гликоген и накапливается в гепатоцитах и мышцах. При наступлении энергетического голода с помощью гормонов организм способен высвобождать гликоген из депо и синтезировать из него глюкозу — это основной путь получения энергии.
Излишки глюкозы в печени используются в производстве гликогена под воздействием гормона поджелудочной железы — инсулина. Гликоген (животный крахмал) — это полисахарид, особенностью строения которого является древообразная структура. Запасают его гепатоциты в форме гранул. Содержание гликогена в печени человека может увеличиваться до 8% от массы клетки после принятия углеводистой еды. Распад нужен, как правило, для удержания уровня глюкозы в процессе пищеварения. При длительном голодании содержание гликогена понижается почти до нуля и снова синтезируется во время пищеварения.
Если у организма повышается потребность в глюкозе — гликоген начинает распадаться. Механизм преобразования происходит, как правило, между приемами пищи, и ускоряется при мышечных нагрузках. Голодание (отсутствие приема пищи в течение не менее 24 часов) приводит к практически полному распаду гликогена в печени. Но при регулярном питании его запасы полностью восстанавливаются. Подобное аккумулирование сахара может существовать очень долго, до возникновения потребности в распаде.
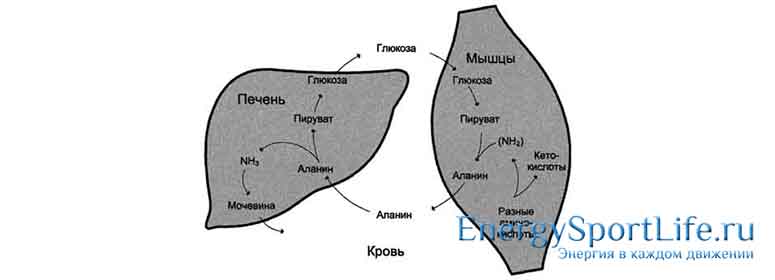
Глюконеогенез – процесс синтеза глюкозы из неуглеводных соединений. Его главная задача — удержание стабильного содержания углеводов в крови при недостатке гликогена или тяжёлой физической работе. Глюконеогенез обеспечивает продукцию сахара до 100 грамм в сутки. В состоянии углеводного голода организм способен синтезировать энергию с альтернативных соединений.
Для использования пути гликогенолиза при необходимости получения энергии нужны следующие вещества:
- Лактат (молочная кислота) – синтезируется при распаде глюкозы. После физических нагрузок возвращается в печень, где снова преобразуется в углеводы. Благодаря этому молочная кислота постоянно участвует в образовании глюкозы;
- Глицерин – результат распада липидов;
- Аминокислоты – синтезируются при распаде мышечных белков и начинают участвовать в образовании глюкозы при истощении запасов гликогена.
Основное количество глюкозы производится в печени (более 70 грамм в сутки). Главной задачей глюконеогенеза является снабжение сахаром мозга.
В организм попадают углеводы не только в виде глюкозы — это может быть и манноза, содержащаяся в цитрусовых. Манноза в результате каскада биохимических процессов преобразуется в соединение, подобное глюкозе. В этом состоянии она вступает в реакции гликолиза.
Путь синтеза и распада гликогена регулируется такими гормонами:
- Инсулин – гормон поджелудочной железы белковой природы. Он понижает содержание сахара в крови. В целом особенностью гормона инсулина является влияние на обмен гликогена, в противоположность глюкагону. Инсулин регулирует дальнейший путь преобразования глюкозы. Под его влиянием происходит транспортировка углеводов в клетки организма, а из их избытков — образование гликогена;
- Глюкагон – гормон голода – вырабатывается поджелудочной железой. Имеет белковую природу. В противоположность инсулину, ускоряет распад гликогена, и способствует стабилизации уровня глюкозы в крови;
- Адреналин – гормон стресса и страха. Его выработка и выделение происходят в надпочечниках. Стимулирует выброс избытка сахара из печени в кровь, для снабжения тканей «питанием» в стрессовой ситуации. Так же, как и глюкагон, в отличие от инсулина, ускоряет катаболизм гликогена в печени.
Перепад количества углеводов в крови активирует производство гормонов инсулина и глюкагона, смену их концентрации, что переключает распад и образование гликогена в печени.
Одной из важных задач печени является регулирование пути синтеза липидов. Липидный обмен в печени включает производство разных жиров (холестерина, триацилглицеридов, фосфолипидов, и др.). Эти липиды поступают в кровь, их присутствие обеспечивает энергией ткани организма.
Печень непосредственно участвует в поддержании энергетического баланса в организме. Ее заболевания способны привести к нарушению важных биохимических процессов, в результате чего будут страдать все органы и системы. Необходимо тщательно следить за своим здоровьем и при необходимости не откладывать визит к врачу.
источник
Гликоген – это запасной углевод животных, состоящий из большого количества остатков глюкозы. Запас гликогена позволяет быстро восполнять недостаток содержания в крови глюкозы, как только её уровень понижается, происходит расщепление гликогена, и в кровь поступает свободная глюкоза. В организме человека глюкоза в основном хранится в виде гликогена. Запасать отдельные молекулы глюкозы клеткам не выгодно, так как это значительно повышало бы осмотическое давление внутри клетки. По своей структуре гликоген напоминает крахмал, то есть полисахарид, который в основном запасают растения. Крахмал тоже состоит из остатков глюкозы, соединённых между собой, однако в молекулах гликогена гораздо больше разветвлений. Качественная реакция на гликоген – реакция с йодом – даёт бурое окрашивание, в отличие от реакции йода с крахмалом, которая позволяет получить фиолетовое окрашивание.
Образование и расщепление гликогена регулируют несколько гормонов, а именно :
1) инсулин
2) глюкагон
3) адреналин
Образование гликогена происходит после того, как концентрация глюкозы в крови повышается: раз глюкозы много, то её необходимо запасти впрок. Поглощение глюкозы клетками в основном регулируется двумя гормонами-антагонистами, то есть гормонами с противоположным действием: инсулином и глюкагоном. Оба гормона выделяются клетками поджелудочной железы.
Обратите внимание: слова «глюкагон» и «гликоген» очень похожи, но глюкагон – это гормон, а гликоген – запасной полисахарид.
Инсулин синтезируется, если глюкозы в крови много. Это обычно бывает после того, как человек поел, в особенности если еда — это богатая углеводами пища (например, если съесть мучное или сладкое). Все углеводы, которые содержатся в пище, расщепляются до моносахаридов, и уже в таком виде через стенку кишечника всасываются в кровь. Соответственно, уровень глюкозы повышается.
Когда рецепторы клеток реагируют на инсулин, клетки поглощают глюкозу из крови, и её уровень вновь снижается. Кстати, именно поэтому диабет – недостаток инсулина – образно называют «голод среди изобилия», ведь в крови после употребления пищи, которая богата углеводами, появляется очень много сахара, но без инсулина клетки не могут его поглотить. Часть глюкозы клетки используют для получения энергии, а оставшуюся превращают в жир. Клетки печени используют поглощённую глюкозу для синтеза гликогена. Если же в крови мало глюкозы, то происходит обратный процесс: поджелудочная железа выделяет гормон глюкагон, и клетки печени начинают расщеплять гликоген, выделяя глюкозу в кровь, или синтезировать глюкозу заново из более простых молекул, таких как молочная кислота.
Адреналин также приводит к распаду гликогена, потому что всё действие этого гормона направлено на то, чтобы мобилизовать организм, подготовить его к реакции по типу «бей или беги». А для этого необходимо, чтобы концентрация глюкозы стала выше. Тогда мышцы смогут использовать её для получения энергии.
Таким образом, поглощение пищи приводит к выделению в кровь гормона инсулина и синтезу гликогена, а голодание – к выделению гормона глюкагона и распаду гликогена. Выделение адреналина, происходящее в стрессовых ситуациях, также приводит к распаду гликогена.
Субстратом для синтеза гликогена, или гликогеногенеза, как его по-другому называют, служит глюкозо-6-фосфат. Это молекула, которая получается из глюкозы после присоединения к шестому атому углерода остатка фосфорной кислоты. Глюкоза, образующая глюкозо-6-фосфат, попадает в печень из крови, а в кровь – из кишечника.
Возможен и другой вариант: глюкоза может быть заново синтезирована из более простых предшественников (молочной кислоты). В таком случае из крови глюкоза попадает, например, в мышцы, где расщепляется до молочной кислоты с выделением энергии, а потом накопленная молочная кислота транспортируется в печень, и клетки печени заново синтезируют из неё глюкозу. Потом эту глюкозу можно превратить в глюкозо-6-фосфот и далее на его основе синтезировать гликоген.
Итак, что же происходит в процессе синтеза гликогена из глюкозы?
1. Глюкоза после присоединения остатка фосфорной кислоты становится глюкозо-6-фосфатом. Это происходит благодаря ферменту гексокиназе. Этот фермент имеет несколько разных форм. Гексокиназа в мышцах немного отличается от гексокиназы в печени. Та форма этого фермента, которая присутствует в печени, хуже связывается с глюкозой, а продукт, образующийся в ходе реакции, не ингибирует протекание реакции. Благодаря этому клетки печени способны поглощать глюкозу только тогда, когда её много, и могу сразу превратить в глюкозо-6-фосфат очень много субстрата, даже если не успевают его переработать.
2. Фермент фосфоглюкомутаза катализирует превращение глюкозо-6-фосфата в его изомер — глюкозо-1-фосфат.
3. Полученный глюкозо-1-фосфат потом соединяется с уридинтрифосфатом, образуя УДФ-глюкозу. Катализирует этот процесс фермент УДФ-глюкозопирофосфорилаза. Эта реакция не может протекать в обратную сторону, то есть является необратимой в тех условиях, которые присутствуют в клетке.
4. Фермент гликогенсинтаза переносит остаток глюкозы на формирующуюся молекулу гликогена.
5. Гликогенразветвляющий фермент добавляет точки ветвления, создавая новые «веточки» на молекуле гликогена. Позже на конец этого ответвления добавляются новые остатки глюкозы с помощью гликогенсинтазы.
Гликоген – это необходимый для жизни запасной полисахарид, и хранится он в виде небольших гранул, находящихся в цитоплазме некоторых клеток.
Гликоген запасают следующие органы :
1. Печень. В печени гликогена довольно много, и это единственный орган, который использует запас гликогена для регуляции концентрации сахара в крови. До 5-6 % может составлять гликоген от массы печени, что примерно соответствует 100-120 граммам.
2. Мышцы. В мышцах запас гликогена меньше в процентном соотношении (до 1 %), однако суммарно по весу может превосходить весь гликоген, запасённый в печени. Мышцы не выделяют ту глюкозу, которая образовалась после распада гликогена, в кровь, они используют её только для своих собственных нужд.
3. Почки. В них обнаружено незначительное количество гликогена. Ещё меньшие количества были найдены в глиальных клетках и в лейкоцитах, то есть белых кровяных клетках.
В процессе жизнедеятельности организма гликоген синтезируется довольно часто, практически каждый раз после еды. Организму нет смысла запасать огромные количества гликогена, ведь основная его функция – это не служить донором питательных веществ как можно дольше, а регулировать количество сахара в крови. Запасов гликогена хватает на срок около 12 часов.
Для сравнения, запасённые жиры :
— во-первых, обычно имеют массу гораздо большую, чем масса запасённого гликогена,
— во-вторых, их может хватить на месяц существования.
К тому же стоит отметить, что организм человека может превращать углеводы в жиры, но не наоборот, то есть запасённый жир превратить в гликоген никак не получится, только напрямую использовать для получения энергии. А вот расщепить гликоген до глюкозы, потом разрушить саму глюкозу и использовать получившийся продукт для синтеза жиров организм человека вполне в состоянии.
источник
Многие годы безуспешно боретесь с БОЛЯМИ в ПЕЧЕНИ?
Глава Института заболеваний печени: «Вы будете поражены, насколько просто можно вылечить печень просто принимая каждый день.
Глюкоза является главным энергетическим материалом для функционирования человеческого тела. В организм она поступает с пищей в виде углеводов. На протяжении многих тысячелетий человек претерпевал массу эволюционных изменений.
Одним из важных приобретенных умений стала способность организма впрок запасать энергетические материалы на случай голода и синтезировать их из других соединений.
Избытки углеводов аккумулируются в организме при участии печени и сложных биохимических реакций. Все процессы накопления, синтеза и использования глюкозы регулируются гормонами.
Существуют следующие пути для использования глюкозы печенью:
- Гликолиз. Сложный многоступенчатый механизм окисления глюкозы без участия кислорода, в результате которого образуется универсальные источники энергии: АТФ и НАДФ — соединения, обеспечивающие энергией протекание всех биохимических и обменных процессов в организме;
- Запасание в виде гликогена при участии гормона инсулина. Гликоген – неактивная форма глюкозы, которая может накапливаться и сберегаться в организме;
- Липогенез. Если глюкозы поступает больше, чем необходимо даже для образования гликогена, начинается синтез липидов.
Роль печени в углеводном обмене огромна, благодаря ей в организме постоянно присутствует запас углеводов, жизненно необходимых организму.
Основная роль печени — регуляция углеводного обмена и глюкозы с последующим депонированием гликогена в гепатоцитах человека. Особенностью является превращение сахара под воздействием узкоспециальных ферментов и гормонов в особую его форму, этот процесс происходит исключительно в печени (необходимое условие потребления её клетками). Эти преобразования ускоряются ферментами гексо- и глюкокиназой при понижении уровня содержания сахара.
В процессе пищеварения (а углеводы начинают расщепляться сразу после попадания еды в ротовую полость) содержание глюкозы в крови повышается, вследствие чего происходит ускорение реакций, направленных на депонирование излишков. Тем самым предупреждается возникновение гипергликемии во время приёма пищи.
Сахар из крови с помощью ряда биохимических реакций в печени преобразуется в неактивное его соединение – гликоген и накапливается в гепатоцитах и мышцах. При наступлении энергетического голода с помощью гормонов организм способен высвобождать гликоген из депо и синтезировать из него глюкозу — это основной путь получения энергии.
Излишки глюкозы в печени используются в производстве гликогена под воздействием гормона поджелудочной железы — инсулина. Гликоген (животный крахмал) — это полисахарид, особенностью строения которого является древообразная структура. Запасают его гепатоциты в форме гранул. Содержание гликогена в печени человека может увеличиваться до 8% от массы клетки после принятия углеводистой еды. Распад нужен, как правило, для удержания уровня глюкозы в процессе пищеварения. При длительном голодании содержание гликогена понижается почти до нуля и снова синтезируется во время пищеварения.
Если у организма повышается потребность в глюкозе — гликоген начинает распадаться. Механизм преобразования происходит, как правило, между приемами пищи, и ускоряется при мышечных нагрузках. Голодание (отсутствие приема пищи в течение не менее 24 часов) приводит к практически полному распаду гликогена в печени. Но при регулярном питании его запасы полностью восстанавливаются. Подобное аккумулирование сахара может существовать очень долго, до возникновения потребности в распаде.
Глюконеогенез – процесс синтеза глюкозы из неуглеводных соединений. Его главная задача — удержание стабильного содержания углеводов в крови при недостатке гликогена или тяжёлой физической работе. Глюконеогенез обеспечивает продукцию сахара до 100 грамм в сутки. В состоянии углеводного голода организм способен синтезировать энергию с альтернативных соединений.
Для использования пути гликогенолиза при необходимости получения энергии нужны следующие вещества:
- Лактат (молочная кислота) – синтезируется при распаде глюкозы. После физических нагрузок возвращается в печень, где снова преобразуется в углеводы. Благодаря этому молочная кислота постоянно участвует в образовании глюкозы;
- Глицерин – результат распада липидов;
- Аминокислоты – синтезируются при распаде мышечных белков и начинают участвовать в образовании глюкозы при истощении запасов гликогена.
Основное количество глюкозы производится в печени (более 70 грамм в сутки). Главной задачей глюконеогенеза является снабжение сахаром мозга.
В организм попадают углеводы не только в виде глюкозы — это может быть и манноза, содержащаяся в цитрусовых. Манноза в результате каскада биохимических процессов преобразуется в соединение, подобное глюкозе. В этом состоянии она вступает в реакции гликолиза.
Путь синтеза и распада гликогена регулируется такими гормонами:
- Инсулин – гормон поджелудочной железы белковой природы. Он понижает содержание сахара в крови. В целом особенностью гормона инсулина является влияние на обмен гликогена, в противоположность глюкагону. Инсулин регулирует дальнейший путь преобразования глюкозы. Под его влиянием происходит транспортировка углеводов в клетки организма, а из их избытков — образование гликогена;
- Глюкагон – гормон голода – вырабатывается поджелудочной железой. Имеет белковую природу. В противоположность инсулину, ускоряет распад гликогена, и способствует стабилизации уровня глюкозы в крови;
- Адреналин – гормон стресса и страха. Его выработка и выделение происходят в надпочечниках. Стимулирует выброс избытка сахара из печени в кровь, для снабжения тканей «питанием» в стрессовой ситуации. Так же, как и глюкагон, в отличие от инсулина, ускоряет катаболизм гликогена в печени.
Перепад количества углеводов в крови активирует производство гормонов инсулина и глюкагона, смену их концентрации, что переключает распад и образование гликогена в печени.
Одной из важных задач печени является регулирование пути синтеза липидов. Липидный обмен в печени включает производство разных жиров (холестерина, триацилглицеридов, фосфолипидов, и др.). Эти липиды поступают в кровь, их присутствие обеспечивает энергией ткани организма.
Печень непосредственно участвует в поддержании энергетического баланса в организме. Ее заболевания способны привести к нарушению важных биохимических процессов, в результате чего будут страдать все органы и системы. Необходимо тщательно следить за своим здоровьем и при необходимости не откладывать визит к врачу.
Циррозом печени называется заболевание, при котором функциональные ткани органа перерождаются в соединительную ткань. Из-за этого печень теряет способность выполнять свои функции и возникает печеночная недостаточность. Заболевание является конечным этапом хронического гепатита, вызванного разными причинами, и входит в шестерку болезней, от которых ежегодно умирает самое большое количество людей.
Мужчины болеют чаще женщин в 3 раза, при этом есть виды цирроза, которым прежде всего подвержены именно женщины. Заболевание приводит к смерти 50% больных через 5 лет после постановки диагноза. Недуг не обходит стороной и детей, при этом детский цирроз появляется из-за тех же причин, что и взрослый.
Цирроз имеет ряд выявленных и сомнительных причин. В 15-35% случаев вообще не удается определить причины цирроза. Это так называемые криптогенные случаи. От чего же обычно появляется заболевание?
Гепатиты В и С являются одной из самых частых причин цирроза. Вирус провоцирует воспаление печеночных клеток, которые называются гепатоцитами. До определенного времени они все еще выполняют свои функции, но в итоге отмирают и замещаются соединительной тканью. Вирусные циррозы быстро прогрессируют и отличаются самыми худшими прогнозами.
Особо опасен гепатит С, так как он долгое время не проявляет себя никакими симптомами. Обнаруживается вирус только во время исследования крови, но чаще всего уже при наличии цирроза. В 95% случаев гепатит С перерастает в печеночную недостаточность.
Помимо вируса, цирроз могут вызвать малярия, сифилис, бруцеллез.
Стоит наравне с вирусными гепатитами, вызывающими необратимые поражения печеночной ткани. Цирроз обнаруживается после 10-15 лет постоянного приема алкогольных напитков. К цирротической печени приводит суточная доза спирта для мужчин в 60 г, а для женщин — в 20 г. Заболевание возникает из-за комплексного воздействия алкоголя.
Именно в этом органе происходит расщепление спирта и его чрезмерное количество напрямую повреждает гепатоциты. Кроме того, большое количество поступающего этанола увеличивает выработку особых противовоспалительных соединений — цитокинов. Под их воздействием ускоряется рубцевание ткани, то есть замещение функциональных покровов на соединительные.
Недостаток питательных веществ является причиной возникновения цирроза наряду с прямым воздействием алкоголя на печень. У алкоголика снижается потребление белков, углеводов, витаминов, так как спирт на 30% замещает потребность в калориях. Особенно опасен недостаток липотропных веществ, которые тормозят накопление жира в печени. Алкогольный цирроз усугубляется возникновением алкогольного гастрита, что затрудняет всасывание витаминов и питательных веществ.
Однако именно алкогольный цирроз считается одним из самых благополучных. Часто для продления жизни до 10-ти лет после постановки диагноза больному достаточно полностью отказаться от приема алкоголя, восстановить нормальное питание и принимать назначенные врачом лекарства.
Чаще всего к появлению цирроза приводят сахарный диабет и болезни щитовидной железы, например, тиреотоксикоз.
Заболевание способно привести к циррозу в том случае, если оно не контролируется самим больным. Глюкоза, которая попадает в печень, либо сразу уходит в кровь, либо накапливается в качестве энергетического резерва. Избыток глюкозы превращается в жир и приводит к развитию гепатоза, который является начальной стадией патологических изменений печени. Воспалительная реакция провоцирует гибель гепатоцитов и последующее образование соединительной ткани вместо функциональной.
Это избыток гормонов щитовидки. При таком состоянии меняются все функции печени, но к циррозу приводит лишь запущенный и неконтролируемый гипертиреоз.
Цирроз появляется из-за того, что иммунная система начинает ошибочно уничтожать функциональные клетки печени. Это самый агрессивный вид заболевания, характеризующийся быстрым развитием и тяжелыми осложнениями. Большинство заболевших — женщины до 30-ти лет.
Первичный билиарный цирроз, причины возникновения которого до недавнего времени оставались неизвестными, многими специалистами теперь рассматривается как форма аутоиммунной болезни. Он развивается у людей в возрасте 40-50 лет из-за нарушения оттока желчи и ее застоя. Чаще болеют женщины, при этом факторы, которые провоцируют начало заболевания не установлены.
Перерабатываемые печенью химические, лекарственные и растительные вредные соединения вызывают появление токсической формы болезни. К отравлению приводит контакт или употребление следующих веществ:
- Химические соединения и тяжелые металлы — бензол, хлороформ, тетрахлорметан, ртуть, свинец
- Лекарства — некоторые антидепрессанты, чрезмерное количество витамина А, анаболики, противогрибковые препараты, андрогены и другие медикаментозные средства, принимаемые длительный промежуток времени
- Природные яды — отравление грибами, особенно бледной поганкой, укусы ядовитых насекомых, змей
Тяжелая степень сердечной недостаточности приводит к отсутствию необходимого кровоснабжения гепатоцитов. В таких условиях функциональные клетки отмирают и на их месте разрастается соединительная ткань.
Если первичный билиарный цирроз развивается на аутоиммунном уровне, то вторичный возникает из-за следующих состояний:
- Образование камней в желчном пузыре
- Появление доброкачественных опухолей
- Аномалии развития желчных протоков
- Воспалительные заболевания желчевыводящей системы
- Увеличение лимфоузлов, находящихся в районе желчных протоков
- Появление рубцовых изменений тканей после хирургических операций
Все эти состояния затрудняют отток желчи, приводят к воспалению гепатоцитов, последующему их отмиранию и перерождению в соединительную ткань. Процесс занимает 4-18 месяцев.
Нарушения на генетическом уровне приводят к появлению или наследованию следующих болезней, из-за которых развивается цирроз:
- Гемохроматоз — железо не усваивается в желудочно-кишечном тракте, интенсивно проникает в кровь и накапливается в печени
- Болезнь Вильсона-Коновалова — связана с нарушением метаболизма меди, которая, оседая в печени, вызывает воспаление ее тканей
- Недостаточное количество альфа1-антитрипсина — соединение влияет на способность гепатоцитов противостоять вредному воздействию различных повреждающих факторов
- Тирозиноз — приводит к отложению в печеночных тканях тирозина и вызывает патологическое увеличение органа
- Гликогенозы — нарушение выработки ферментов, отвечающих за производство и распад гликогена
В запущенных случаях, проникшие в печень черви-сосальщики — трематоды — способны вызвать цирроз. Особому риску подвергаются люди, постоянно работающие с животными, употребляющие рыбу сомнительного качества или плохо обработанную, предпочитающие купаться в пресных водоемах. Паразиты попадают в организм человека не только при заглатывании воды, но и через слизистые и даже кожу, например, так ведут себя шистосомы.
Обычно выявление паразитов происходит задолго до того, как их деятельность доведет до патологического состояния. Однако паразитарная форма болезни все-таки случается, если нет возможности пройти специальную диагностику или зараженный человек по каким-либо причинам не обращается к врачам.
Половина всех случаев развития заболевания провоцируется несколькими причинами одновременно. Чаще всего это сочетание гепатита В и алкогольной зависимости, так как употребление спиртных напитков ослабляет иммунитет.
В 35% случаев цирроза не удается выявить истинные причины заболевания. Клинические проявления при многих формах болезни одинаковы. Выделяется по крайней мере два типа цирроза, которые имеют специфическую симптоматику, но причина их появления не установлена:
- Индийский цирроз у детей
- Первичный билиарный — на данный момент многие специалисты считают его аутоиммунным заболеванием
Все остальные формы болезни относятся к криптогенным.
Дети любого возраста не застрахованы от возникновения этого заболевания. Причинами развития цирроза у детей являются те же, что и у взрослых, при этом имеются некоторые особенности:
- Вирусное поражение — становится одной из главных причин появления недуга, при котором клетки детской печени погибают особенно быстро
- Лекарственные средства — на печень губительно действуют препараты против туберкулеза и применяемые от злокачественных изменений кроветворной системы, например, лейкемии
- Первичный билиарный цирроз у детей появляется крайне редко
- Сифилис поражает печень только у новорожденных малышей
- Обменные заболевания — муковисцидоз приводит к повышению вязкости желчи у детей и закупорке протоков. Выявляются нарушения обмена железа, гликогенозы и дефицит альфа1-антитрипсина. От болезни Вильсона-Коновалова, при которой изменяется метаболизм меди, страдает до 10% всех дошкольников с диагностированным циррозом
- Генетические причины чаще проявляются при рождении детей с аномальным строением желчных протоков
- Аутоиммунный гепатит диагностируется у девочек и девушек в возрасте 10-20 лет в половине случаев от всех больных женского пола, имеющих этот тип заболевания — болезнь очень быстро переходит в цирроз
- Венозные печеночные застои у детей появляются из-за врожденных пороков сердца
- Особое внимание уделяется алкогольному циррозу. Все больше детей из семей с низким уровнем жизни и неблагоприятной обстановкой приобретают именно эту форму болезни
Индийская форма заболевания относится к криптогенным. Ей подвержены дети, проживающие в Индии в сельских районах и в семьях со средним достатком. Обычно заболевание обнаруживается у детей в возрасте 1-3 лет, а смертельный исход наступает уже через год после постановки диагноза. Предполагаемыми причинами являются наследственный фактор и качество питьевой воды, так как анализы выявляют повышенную концентрацию меди.
Так как при этой болезни происходит замещение печеночной ткани соединительной, то выполнение печенью своих функций становится невозможным. Изменения и гибель гепатоцитов необратимы. Основными причинами смерти при циррозе становятся:
- Печеночная энцефалопатия — печень больше не способна выполнять очистительные функции. Все загрязнения попадают в кровь и разносятся по организму. Больше всего страдает мозг человека. Люди с этим диагнозом живут не более года
- Внутренние кровотечения — возникают из-за того, что спайки соединительной ткани перекрывают печеночное кровообращение и являются причиной повышения портального венозного давления. Кровотечение бывает скрытого характера. Они особенно опасны, если возникают в органах ЖКТ. Приводят к смерти 30% больных, у которых было выявлено внутреннее кровотечение
- Асцит — удержание жидкости в брюшной полости. Выявляются случаи, когда накапливается до 25-ти литров воды. Заболевание может привести к перитониту. При тяжелых стадиях больные способны прожить не более года
Вероятность летального исхода при циррозе определяется многими факторами — типом болезни, ее стадией, возрастом и полом больного, сопутствующими заболеваниями, желанием пациента затормозить развитие недуга и активным участием в терапевтическом процессе. Излечить цирроз печени невозможно, так как нельзя восстановить поврежденные ткани органа. Зная, от чего появляется заболевание, очень часто можно предотвратить его развитие.
- 1 Суть метаболической функции
- 2 Метаболизм углеводов в печени
- 3 Метаболизм липидов
- 4 Метаболизм белков
- 5 Метаболизм гормонов
- 6 Лекарственный метаболизм
В печени происходит ряд реакций, объединенных в одну группу – метаболических. На их основе построена вся жизнедеятельность живого организма. Печень участвует в синтезе белков, в выработке веществ для пищеварения, в детоксикационных процессах. Без печеночного метаболизма невозможно обеспечить организм всем необходимым для нормальной работы органов и систем.

Печень – это особая железа, участвующая в производстве и преобразовании большого количества веществ, передаваемых в другие участки организма. Благодаря высокой скорости печеночного метаболизма происходит своевременное перераспределение энергии и субстратов между разными системами и тканями. В природной биохимической лаборатории происходит четыре важных процесса:
- обмен белков;
- расщепление жиров;
- преобразование углеводов;
- детоксикация крови, например, при длительном лечении лекарствами.
Для лечения печени наши читатели успешно используют Leviron Duo. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Обеспечивает производство и расход гликогена, необходимого для поддержания углеводного гомеостаза и устойчивой гликемии. Если в крови происходят колебания уровня глюкозы, наблюдается возрастание или падение потребления энергии организмом. В результате продуцируются гормоны надпочечников и поджелудочной железы, такие как адреналин и глюкагон. Процесс сопровождается печеночным гликогенезом с выведением глюкозы в плазму крови. Частично глюкоза расходуется на производство жирных и желчных кислот, гликопротеидов и стероидных гормонов.
Для расщепления жиров необходимы желчные кислоты, получаемые при углеводном метаболизме. При их недостатке переваривания липидов не происходит. Липидный метаболизм необходим в качестве запасного варианта, если нарушен синтез глюкозы. В этом случае печень активирует процессы окисления жирных кислот с образованием необходимого биоматериала для получения недостающего сахара. В условиях переизбытка глюкозы происходит активизация продукции из жирных кислот таких веществ, как триглицериды и фосфолипиды в гепатоцитах. При липидном обмене также осуществляется обмен холестерола. Если вещество начинает образовываться из ацетил-КоА в большом количестве, значит, происходит избыточное питание организма извне.

Чтобы все вещества попадали по назначению, в гепатоцитах метаболизируется транспортный липопротеин. Он отвечает за передачу всех полезных микровеществ в пункты назначения через кровь. Для обеспечения стабильной работы сердца и корки надпочечников в печени вырабатываются кетоновые частицы в виде ацетоацетата и гидрооксимаслянной кислоты. Эти соединения поглощаются органами вместо глюкозы.
Процесс основана на переработке печенью аминокислот, поступающих из пищеварительного тракта. Из них производятся печеночные протеины для дальнейшего их преобразования в белки плазмы крови. Дополнительно в печеночных тканях формируются такие вещества, как фибриноген, альбумин, a- и b-глобулины, липопротеиды, необходимые для осуществления работы других органов и систем. В обязательном порядке создает резервный запас аминокислот в виде лабильного белка, который будет в дальнейшем использоваться по мере необходимости или недостатка прямого печеночного белка. Процесс белкового обмена при помощи кишечных аминокислот играет центральную роль в печеночном метаболизме. В качестве дополняющей функции в печеночных тканях происходит синтез мочевины.

Эта функция печени является ключевой в процессе образования стероидных гомонов, хотя сам орган не производит их. В печеночных тканях синтезируется только гепарин. Несмотря на это, при поражении гепатоцитов происходит существенный рост содержания гормонов в крови, например, эстрогенов, кетостероидов, оксикокортикостероидов с уменьшением их экскреции. В результате развиваются множественные дисфункции в организме. Если нарушается синтез транспортного белка по причине отмирания гепатоцитов, нарушается процесс связывания гидрокортизона и происходит инактивация инсулина. Это ведет к гипогликемии. Одновременно печень регулирует синтез дофамина, адреналина и его производных.
Расщепление, преобразование и вывод лекарств происходит в печени. Но чтобы они проникли в орган, их нужно трансформировать в жирорастворимую форму. После попадания в печень на фоне воздействия ферментов микросомальной оксидазы в гепатоцитах компонентам лекарства придается водорастворимая форма. Полученные продукты распада выводятся с мочой и желчью. Качество работы печени по выведению лекарств определяется:
- активностью ее ферментов;
- наличием достаточного клиренса;
- нормальным кровотоком;
- степенью связывания лекарства белками крови, синтезированными посредством печени.
источник