глюкоза постоянно поступает в клетки печени через трансмембранный переносчик GLUT2; инсулин мобилизует дополнительный трансмембранный переносчик GLUT4, способствуя его встраиванию в плазматическую мембрану гепатоцитов.
способствует синтезу гликогена из поступающей в гепатоциты глюкозы путём увеличения транскрипции гена глюкокиназы и активирования гликоген синтазы;
предупреждает распад гликогена путём ингибирования активности гликоген фосфорилазы и глюкозо-6-фосфатазы;
стимулирует гликолиз и окисление углеводов путём активирования глюкокиназы, фосфофруктокиназы и пируват киназы;
активирует метаболизм глюкозы через гексозомонофосфатный шунт;
ускоряет окисление пирувата путём активирования пируватдегидрогеназы;
подавляет глюконеогенез путём ингибирования активности фосфоенолпируват карбоксикиназы, фруктозо-1,6-бифосфатазы и глюкозо-6-фосфатазы;
активирует поступление глюкозы в саркоплазму посредством трансмембранного переносчика GLUT4, способствуя его встраиванию в плазматическую мембрану.
способствует синтезу гликогена из поступающей в гепатоциты глюкозы путём увеличения транскрипции гена гексокиназы и активирования гликоген синтазы;
стимулирует гликолиз и окисление углеводов путём активирования гексокиназы, фосфофруктокиназы и пируват киназы;
Жировая ткань. Инсулин влияет на метаболизм адипоцитов следующим образом:
активирует поступление глюкозы в саркоплазму посредством трансмембранного переносчика GLUT4, способствуя его встраиванию в плазматическую мембрану.
стимулирует гликолиз, что приводит к образованию -глицерофосфата, идущего на построение триглицеридов;
ускоряет окисление пирувата путём активирования пируватдегидрогеназы и ацетил-КоА‑карбоксилазы, что благоприятствует синтезу свободных жирных кислот;
ЦНС. Инсулин практически не оказывает влияния ни на транспорт глюкозы в нервные клетки, ни на их метаболизм. Нейроны головного мозга отличаются от клеток других органов тем, что они используют как основной источник энергии преимущественно глюкозу, но не жирные кислоты. Более того, нервные клетки не приспособлены синтезировать глюкозу. Именно поэтому бесперебойное поступление глюкозы в головной мозг столь важно для функционирования и выживания нейронов.
Другие органы. Как и ЦНС, многие органы (например, почка и кишечник) не чувствительны к инсулину.
Содержание глюкозы во внутренней среде организма должно находиться в строго ограниченных пределах. Так, натощак концентрация глюкозы в плазме крови колеблется в пределах 60–90 мг% (нормогликемия), увеличивается до 100–140 мг% (гипергликемия) в течение одного часа после еды и обычно в течение 2 часов возвращается к нормальным значениям. Существуют ситуации, когда концентрация глюкозы в плазме крови уменьшается до 60 мг% и ниже (гипогликемия). Необходимость поддержания постоянной концентрации глюкозы в крови диктуется тем, что мозг, сетчатка и некоторые другие клетки и органы в качестве источника энергии используют преимущественно глюкозу. Так, в периоды между приёмами пищи основная часть глюкозы, находящаяся во внутренней среде организме, используется для метаболизма мозга.
Гомеостаз глюкозы поддерживают следующие механизмы.
Печень демпфирует колебания концентрации глюкозы. Так, когда содержание глюкозы в крови повышается до высоких концентраций после приёма пищи и объём секреции инсулина увеличивается, то более 60% глюкозы, всосавшейся из кишечника, депонируется в печени в форме гликогена. В последующие часы, когда концентрация глюкозы и секреция инсулина снижаются, печень выделяет глюкозу в кровь.
Инсулин и глюкагон реципрокно регулируют нормальное содержание глюкозы в крови. Повышение содержания глюкозы выше нормы посредством механизма обратной связи действует на ‑клетки островков Лангерханса и вызывает повышенную секрецию инсулина. что приводит концентрацию глюкозы к норме. Понижение содержания глюкозы ниже нормы тормозит образование инсулина, но стимулирует секрецию глюкагона, что приводит содержание глюкозы к норме.
Гипогликемия оказывает прямое влияние на гипоталамус, который возбуждает симпатическую нервную систему. В результате адреналин секретируется из надпочечников и увеличивает выделение глюкозы печенью.
Продолжительная гипогликемия стимулирует выделение СТГ и кортизола, которые уменьшают скорость потребления глюкозы большинством клеток организма, что помогает возвращению концентрации глюкозы в крови к нормальному уровню.
После приёма пищи всосавшиеся в кишечнике моносахариды, триглицериды и аминокислоты по воротным венам поступают в печень, где различные моносахариды превращаются в глюкозу. Глюкоза в печени хранится в виде гликогена (синтез гликогена происходит также в мышцах), в печени окисляется лишь малая часть глюкозы. Глюкоза, не захваченная гепатоцитами, оказывается в системе общей циркуляции и поступает в различные органы, где окисляется до воды и CO2.и обеспечивает энергетические потребности этих органов.
Инкретины. При поступления химуса в кишечник из эндокринных клеток его стенки во внутреннюю среду организма выделяются так называемые инкретины (желудочный ингибирующий пептид, энтероглюкагон [глицентин] и глюкагоноподобный пептид 1), потенцирующие вызванную глюкозой секрецию инсулина.
Всасывание глюкозы из просвета кишечника происходит при помощи встроенных в апикальную плазматическую мембрану энтероцитов Na + –зависимых транспортёров сочетанного переноса ионов натрия и глюкозы, требующих (в отличие от переносчиков глюкозы GLUT) затрат энергии. Напротив, выход глюкозы из энтероцитов во внутреннюю среду организма, происходящий через плазмолемму их базальной части, происходит путём облегчённой диффузии.
Фильтрация молекул глюкозы из просвета кровеносных капилляров почечных телец в полость капсулы Боумена–Шумлянского осуществляется пропорционально концентрации глюкозы в плазме крови.
Реабсорбция. Обычно вся глюкоза реабсорбируется в первой половине проксимальных извитых канальцев со скоростью 1,8 ммоль/мин (320 мг/мин). Реабсорбция глюкозы происходит (как и её всасывание в кишечнике) при помощи сочетанного переноса ионов натрия и глюкозы.
Секреция. Глюкоза у здоровых лиц не секретируется в просвет канальцев нефрона.
Глюкозурия. Глюкоза появляется в моче при её содержании в плазме крови свыше 10 мМ.
Между приёмами пищи глюкоза поступает в кровь из печени, где образуется за счёт гликогенолиза (распад гликогена до глюкозы) и глюконеогенеза (образование глюкозы из аминокислот, лактата, глицерола и пирувата). Из-за малой активности глюкозо-6-фосфатазы глюкоза не поступает в кровь из мышц.
В покое содержание глюкозы в плазме крови составляет 4,5–5,6 мМ, а общее содержание глюкозы (расчёты для взрослого здорового мужчины) в 15 л межклеточной жидкости — 60 ммоль (10,8 г), что примерно соответствует ежечасному расходу этого сахара. Следует помнить, что ни в ЦНС, ни в эритроцитах глюкоза не синтезируется и не хранится в виде гликогена и в то же время является крайне важным источником энергии.
Между приёмами пищи преобладают гликогенолиз, глюконеогенез и липолиз. Даже при непродолжительном голодании (24–48 часов) развивается обратимое состояние, близкое к сахарному диабету — голодный диабет. При этом нейроны начинают использовать в качестве источника энергии кетоновые тела.
При физической нагрузке потребление глюкозы возрастает в несколько раз. При этом увеличиваются гликогенолиз, липолиз и глюконеогенез, регулируемые инсулином, а также функциональными антагонистами инсулина (глюкагон, катехоламины, СТГ, кортизол).
Глюкагон. Эффекты глюкагона (см. ниже).
Катехоламины. Физическая нагрузка через гипоталамические центры (гипоталамический глюкостат) активирует симпатоадреналовую систему. В результате уменьшается выброс инсулина из -клеток, увеличивается секреция глюкагона из -клеток, возрастает поступление в кровь глюкозы из печени, усиливается липолиз. Катехоламины также потенцируют вызванное T3 и T4 увеличение потребления кислорода митохондриями.
Гормон роста способствует увеличению содержания глюкозы в плазме крови за счёт усиления гликогенолиза в печени, уменьшения чувствительности мышц и жировых клеток к инсулину (в результате уменьшается поглощение ими глюкозы), а также за счёт стимуляции выброса глюкагона из -клеток.
Глюкокортикоиды стимулируют гликогенолиз и глюконеогенез, но подавляют транспорт глюкозы из крови в разные клетки.
Глюкостат. Регуляция содержания глюкозы во внутренней среде организма имеет целью поддержание гомеостаза этого сахара в пределах нормальных значений (концепция глюкостата) и осуществляется на разных уровнях. Выше рассмотрены механизмы поддержания гомеостаза глюкозы на уровне поджелудочной железы и органов–мишеней инсулина (периферический глюкостат). Считают, что центральную регуляцию содержания глюкозы (центральный глюкостат) осуществляют чувствительные к инсулину нервные клетки гипоталамуса, посылающие далее сигналы активации симпатоадреналовой системы, а также к синтезирующим кортиколиберин и соматолиберин нейронам гипоталамуса. Отклонения содержания глюкозы во внутренней среде организма от нормальных значений, о чём судят по содержанию глюкозы в плазме крови, приводят к развитию гипергликемии или гипогликемии.
Гипогликемия — снижение содержания глюкозы в крови менее 3,33 ммоль/л. Гипогликемия может возникать у здоровых лиц через несколько дней голодания. Клинически гипогликемия проявляется при снижении уровня глюкозы ниже 2,4–3,0 ммоль/л. Ключ к диагностике гипогликемии — триада Уиппла: нервно-психические проявления при голодании, глюкоза крови менее 2,78 ммоль/л, купирование приступа пероральным или внутривенным введением раствора декстрозы (40–60 мл 40% раствора глюкозы). Крайнее проявление гипогликемии — гипогликемическая кома.
Гипергликемия. Массовое поступление глюкозы во внутреннюю среду организма приводит к увеличению её содержания в крови — гипергликемии (содержание глюкозы в плазме крови превышает 6,7 мМ.). Гипергликемия стимулирует секрецию инсулина из -клеток и подавляет секрецию глюкагона из -клеток островков Лангерханса. Оба гормона блокируют в печени образование глюкозы как в ходе гликогенолиза, так и глюконеогенеза. Гипергликемия — так как глюкоза является осмотически активным веществом — может привести к обезвоживанию клеток, развитию осмотического диуреза с потерей электролитов. Гипергликемия может вызвать повреждение многих тканей, в особенности кровеносных сосудов. Гипергликемия — характерный симптом сахарного диабета.
Сахарный диабет типа I. Недостаточная секреция инсулина приводит к развитию гипергликемии — повышенного содержания глюкозы в плазме крови. Постоянный дефицит инсулина является причиной развития генерализованного и тяжёлого метаболического заболевания с поражением почек (диабетическая нефропатия), сетчатки (диабетическая ретинопатия), артериальных сосудов (диабетическая ангиопатия), периферических нервов (диабетическая невропатия) — инсулинзависимого сахарного диабета (сахарный диабет типа I, начинается заболевание преимущественно в молодом возрасте). Эта форма сахарного диабета развивается в результате аутоиммунной деструкции -клеток островков Лангерханса поджелудочной железы и значительно реже вследствие мутаций гена инсулина и генов, принимающих участие в синтезе и секреции инсулина. Постоянный дефицит инсулина приводит к массе последствий: например, в печени образуется значительно больше, чем в у здоровых лиц, глюкозы и кетонов, что в первую очередь сказывается на функции почек: развивается осмотический диурез. Поскольку кетоны являются сильными органическими кислотами, то у больных без лечения неизбежен метаболический кетоацидоз. Лечение сахарного диабета типа I — заместительная терапия внутривенным введением препаратов инсулина. В настоящее время применяют препараты рекомбинантного (полученного методами генной инженерии) инсулина человека. Применявшиеся с 30-х годов XX века инсулины свиней и коров отличаются от инсулина человека 1 и 3 аминокислотными остатками, что достаточно для развития иммунологических конфликтов (согласно данным последних рандомизированных клинических испытаний, использовать свиные инсулины можно наравне с инсулином человека. Парадоксально, но факт!)
Сахарный диабет типа II. При этой форме сахарного диабета («диабет пожилых», развивается преимущественно после 40 лет жизни, встречается в 10 раз чаще, чем сахарный диабет типа I) ‑клетки островков Лангерханса не погибают и продолжают синтезировать инсулин (отсюда другое название заболевания — инсулин-независимый сахарный диабет). При этой болезни либо наблюдается нарушение секреции инсулина (избыточное содержание сахара в крови не увеличивает секрецию инсулина), либо извращена реакция клеток–мишеней на инсулин (развивается нечувствительность — резистентность к инсулину), либо имеют значение оба фактора. Поскольку дефицита инсулина нет, то вероятность развития метаболического кетоацидоза низка. В большинстве случаев лечение сахарного диабета типа II проводят при помощи перорального приёма производных сульфонилмочевины (см. выше раздел «Регуляторы секреции инсулина»).
источник
Одним из наиболее важных влияний инсулина является депонирование в печени всасываемой после приема пищи глюкозы в виде гликогена. В промежутках между приемами пищи, когда нет поступлений питательных веществ и концентрация глюкозы в крови начинает снижаться, параллельно быстро снижается секреция инсулина. Гликоген в печени начинает распадаться до глюкозы, которая высвобождается в кровь и препятствует падению концентрации глюкозы до слишком низкого уровня.
Механизм, с помощью которого инсулин обеспечивает поступление и депонирование глюкозы в печени, включает несколько почти одновременных этапов.
1. Инсулин инактивирует фосфорилазу печени— основной фермент, способствующий распаду гликогена печени до глюкозы. Это предупреждает распад гликогена, который в таком случае запасается в клетках печени.
2. Инсулин обеспечивает усиление поступления глюкозы из крови в клетки печени. Это достигается увеличением активности фермента глюкокиназы, являющейся одним из ферментов, инициирующих фосфорилирование глюкозы после ее диффузии в клетки печени. После фосфорилирования глюкоза временно остается как бы в ловушке в клетке печени, т.к. в такой форме она не может диффундировать обратно через клеточную мембрану.
3. Инсулин также увеличивает активность ферментов, обеспечивающих синтез гликогена, особенно гликогенсинтетазы, ответственной за полимеризацию моносахаридов — единиц, из которых образуется молекула гликогена.
Значение всех этих изменений заключается в увеличении содержания гликогена в печени. В целом содержание гликогена в печени при увеличении его синтеза может составить 5-6% массы печени, что соответствует приблизительно 100 г гликогена, составляющего депо гликогена в печени.
Глюкоза высвобождается из печени в промежутках между приемами пищи. Если уровень глюкозы в крови начинает снижаться до нижнего предела в промежутках между приемами пищи, это приведен к ряду изменений и послужит поводом для высвобождения глюкозы из печени в кровоток.
1. Снижение уровня глюкозы приводит к снижению секреции инсулина поджелудочной железой.
2. Отсутствие инсулина приведет к изменению направления реакций, нацеленных на создание запаса гликогена, главным образом к остановке дальнейшего синтеза гликогена в печени и предупреждению поступления глюкозы в печень из крови.
3. Отсутствие инсулина (параллельно с увеличением глюкагона, что будет рассмотрено далее) активирует фермент фосфорилазу, расщепляющую гликоген до глюкозофосфата.
4. Фермент глюкофосфатаза, ингибируемый инсулином, при отсутствии инсулина активируется и приводит к отщеплению фосфатного радикала от глюкозы, что позволяет свободной глюкозе вернуться в кровь.
Таким образом, печень забирает глюкозу из крови, когда в крови возникает ее избыток в связи с приемом пищи, и возвращает ее в кровь, когда концентрация глюкозы снижается в промежутках между приемами пищи. Обычно около 60% глюкозы пищи запасается таким способом в печени и в последующем возвращается в кровь.
Инсулин обеспечивает превращение избытка глюкозы в жирные кислоты и ингибирует глюконеогенез в печени.
Если поступление глюкозы превышает возможности запасания ее в виде гликогена или возможности ее локальных метаболических превращений в гепатоцитах, инсулин обеспечивает превращение избытка глюкозы в жирные кислоты. Жирные кислоты впоследствии в виде триглицеридов переводятся в липопротеины очень низкой плотности и в таком виде транспортируются кровью в жировую ткань, где депонируются в виде жира.
Инсулин также тормозит глюконеогенез. Это достигается снижением как количества, так и активности ферментов, необходимых для глюконеогенеза. Однако эти эффекты частично вызваны снижением высвобождения аминокислот из мышц и других внепеченочных тканей и вследствие этого — снижением необходимого для глюконеогенеза сырья. Это будет обсуждаться далее в связи с влиянием инсулина на обмен белка.
источник
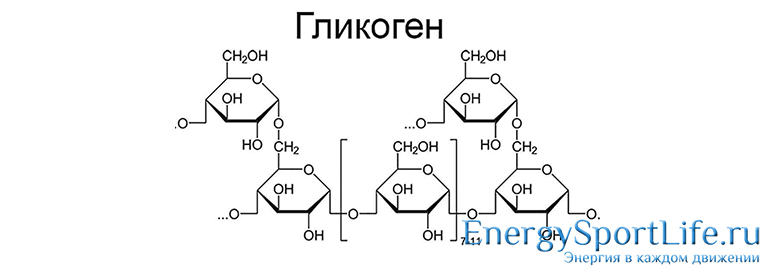
Гликоген – это запасной углевод животных, состоящий из большого количества остатков глюкозы. Запас гликогена позволяет быстро восполнять недостаток содержания в крови глюкозы, как только её уровень понижается, происходит расщепление гликогена, и в кровь поступает свободная глюкоза. В организме человека глюкоза в основном хранится в виде гликогена. Запасать отдельные молекулы глюкозы клеткам не выгодно, так как это значительно повышало бы осмотическое давление внутри клетки. По своей структуре гликоген напоминает крахмал, то есть полисахарид, который в основном запасают растения. Крахмал тоже состоит из остатков глюкозы, соединённых между собой, однако в молекулах гликогена гораздо больше разветвлений. Качественная реакция на гликоген – реакция с йодом – даёт бурое окрашивание, в отличие от реакции йода с крахмалом, которая позволяет получить фиолетовое окрашивание.
Образование и расщепление гликогена регулируют несколько гормонов, а именно :
1) инсулин
2) глюкагон
3) адреналин
Образование гликогена происходит после того, как концентрация глюкозы в крови повышается: раз глюкозы много, то её необходимо запасти впрок. Поглощение глюкозы клетками в основном регулируется двумя гормонами-антагонистами, то есть гормонами с противоположным действием: инсулином и глюкагоном. Оба гормона выделяются клетками поджелудочной железы.
Обратите внимание: слова «глюкагон» и «гликоген» очень похожи, но глюкагон – это гормон, а гликоген – запасной полисахарид.
Инсулин синтезируется, если глюкозы в крови много. Это обычно бывает после того, как человек поел, в особенности если еда — это богатая углеводами пища (например, если съесть мучное или сладкое). Все углеводы, которые содержатся в пище, расщепляются до моносахаридов, и уже в таком виде через стенку кишечника всасываются в кровь. Соответственно, уровень глюкозы повышается.
Когда рецепторы клеток реагируют на инсулин, клетки поглощают глюкозу из крови, и её уровень вновь снижается. Кстати, именно поэтому диабет – недостаток инсулина – образно называют «голод среди изобилия», ведь в крови после употребления пищи, которая богата углеводами, появляется очень много сахара, но без инсулина клетки не могут его поглотить. Часть глюкозы клетки используют для получения энергии, а оставшуюся превращают в жир. Клетки печени используют поглощённую глюкозу для синтеза гликогена. Если же в крови мало глюкозы, то происходит обратный процесс: поджелудочная железа выделяет гормон глюкагон, и клетки печени начинают расщеплять гликоген, выделяя глюкозу в кровь, или синтезировать глюкозу заново из более простых молекул, таких как молочная кислота.
Адреналин также приводит к распаду гликогена, потому что всё действие этого гормона направлено на то, чтобы мобилизовать организм, подготовить его к реакции по типу «бей или беги». А для этого необходимо, чтобы концентрация глюкозы стала выше. Тогда мышцы смогут использовать её для получения энергии.
Таким образом, поглощение пищи приводит к выделению в кровь гормона инсулина и синтезу гликогена, а голодание – к выделению гормона глюкагона и распаду гликогена. Выделение адреналина, происходящее в стрессовых ситуациях, также приводит к распаду гликогена.
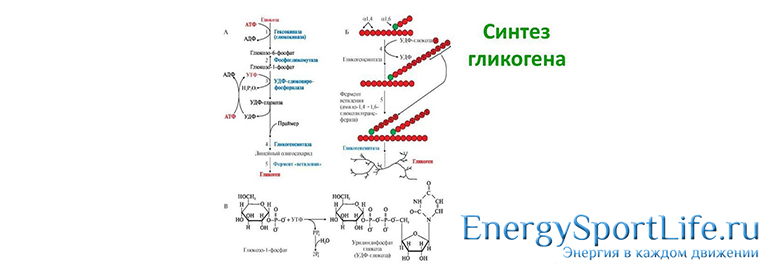
Субстратом для синтеза гликогена, или гликогеногенеза, как его по-другому называют, служит глюкозо-6-фосфат. Это молекула, которая получается из глюкозы после присоединения к шестому атому углерода остатка фосфорной кислоты. Глюкоза, образующая глюкозо-6-фосфат, попадает в печень из крови, а в кровь – из кишечника.
Возможен и другой вариант: глюкоза может быть заново синтезирована из более простых предшественников (молочной кислоты). В таком случае из крови глюкоза попадает, например, в мышцы, где расщепляется до молочной кислоты с выделением энергии, а потом накопленная молочная кислота транспортируется в печень, и клетки печени заново синтезируют из неё глюкозу. Потом эту глюкозу можно превратить в глюкозо-6-фосфот и далее на его основе синтезировать гликоген.
Итак, что же происходит в процессе синтеза гликогена из глюкозы?
1. Глюкоза после присоединения остатка фосфорной кислоты становится глюкозо-6-фосфатом. Это происходит благодаря ферменту гексокиназе. Этот фермент имеет несколько разных форм. Гексокиназа в мышцах немного отличается от гексокиназы в печени. Та форма этого фермента, которая присутствует в печени, хуже связывается с глюкозой, а продукт, образующийся в ходе реакции, не ингибирует протекание реакции. Благодаря этому клетки печени способны поглощать глюкозу только тогда, когда её много, и могу сразу превратить в глюкозо-6-фосфат очень много субстрата, даже если не успевают его переработать.
2. Фермент фосфоглюкомутаза катализирует превращение глюкозо-6-фосфата в его изомер — глюкозо-1-фосфат.
3. Полученный глюкозо-1-фосфат потом соединяется с уридинтрифосфатом, образуя УДФ-глюкозу. Катализирует этот процесс фермент УДФ-глюкозопирофосфорилаза. Эта реакция не может протекать в обратную сторону, то есть является необратимой в тех условиях, которые присутствуют в клетке.
4. Фермент гликогенсинтаза переносит остаток глюкозы на формирующуюся молекулу гликогена.
5. Гликогенразветвляющий фермент добавляет точки ветвления, создавая новые «веточки» на молекуле гликогена. Позже на конец этого ответвления добавляются новые остатки глюкозы с помощью гликогенсинтазы.
Гликоген – это необходимый для жизни запасной полисахарид, и хранится он в виде небольших гранул, находящихся в цитоплазме некоторых клеток.
Гликоген запасают следующие органы :
1. Печень. В печени гликогена довольно много, и это единственный орган, который использует запас гликогена для регуляции концентрации сахара в крови. До 5-6 % может составлять гликоген от массы печени, что примерно соответствует 100-120 граммам.
2. Мышцы. В мышцах запас гликогена меньше в процентном соотношении (до 1 %), однако суммарно по весу может превосходить весь гликоген, запасённый в печени. Мышцы не выделяют ту глюкозу, которая образовалась после распада гликогена, в кровь, они используют её только для своих собственных нужд.
3. Почки. В них обнаружено незначительное количество гликогена. Ещё меньшие количества были найдены в глиальных клетках и в лейкоцитах, то есть белых кровяных клетках.
В процессе жизнедеятельности организма гликоген синтезируется довольно часто, практически каждый раз после еды. Организму нет смысла запасать огромные количества гликогена, ведь основная его функция – это не служить донором питательных веществ как можно дольше, а регулировать количество сахара в крови. Запасов гликогена хватает на срок около 12 часов.
Для сравнения, запасённые жиры :
— во-первых, обычно имеют массу гораздо большую, чем масса запасённого гликогена,
— во-вторых, их может хватить на месяц существования.
К тому же стоит отметить, что организм человека может превращать углеводы в жиры, но не наоборот, то есть запасённый жир превратить в гликоген никак не получится, только напрямую использовать для получения энергии. А вот расщепить гликоген до глюкозы, потом разрушить саму глюкозу и использовать получившийся продукт для синтеза жиров организм человека вполне в состоянии.
источник
Глюкоза является главным энергетическим материалом для функционирования человеческого тела. В организм она поступает с пищей в виде углеводов. На протяжении многих тысячелетий человек претерпевал массу эволюционных изменений.
Одним из важных приобретенных умений стала способность организма впрок запасать энергетические материалы на случай голода и синтезировать их из других соединений.
Избытки углеводов аккумулируются в организме при участии печени и сложных биохимических реакций. Все процессы накопления, синтеза и использования глюкозы регулируются гормонами.
Существуют следующие пути для использования глюкозы печенью:
- Гликолиз. Сложный многоступенчатый механизм окисления глюкозы без участия кислорода, в результате которого образуется универсальные источники энергии: АТФ и НАДФ — соединения, обеспечивающие энергией протекание всех биохимических и обменных процессов в организме;
- Запасание в виде гликогена при участии гормона инсулина. Гликоген – неактивная форма глюкозы, которая может накапливаться и сберегаться в организме;
- Липогенез. Если глюкозы поступает больше, чем необходимо даже для образования гликогена, начинается синтез липидов.
Роль печени в углеводном обмене огромна, благодаря ей в организме постоянно присутствует запас углеводов, жизненно необходимых организму.
Основная роль печени — регуляция углеводного обмена и глюкозы с последующим депонированием гликогена в гепатоцитах человека. Особенностью является превращение сахара под воздействием узкоспециальных ферментов и гормонов в особую его форму, этот процесс происходит исключительно в печени (необходимое условие потребления её клетками). Эти преобразования ускоряются ферментами гексо- и глюкокиназой при понижении уровня содержания сахара.
В процессе пищеварения (а углеводы начинают расщепляться сразу после попадания еды в ротовую полость) содержание глюкозы в крови повышается, вследствие чего происходит ускорение реакций, направленных на депонирование излишков. Тем самым предупреждается возникновение гипергликемии во время приёма пищи.
Сахар из крови с помощью ряда биохимических реакций в печени преобразуется в неактивное его соединение – гликоген и накапливается в гепатоцитах и мышцах. При наступлении энергетического голода с помощью гормонов организм способен высвобождать гликоген из депо и синтезировать из него глюкозу — это основной путь получения энергии.
Излишки глюкозы в печени используются в производстве гликогена под воздействием гормона поджелудочной железы — инсулина. Гликоген (животный крахмал) — это полисахарид, особенностью строения которого является древообразная структура. Запасают его гепатоциты в форме гранул. Содержание гликогена в печени человека может увеличиваться до 8% от массы клетки после принятия углеводистой еды. Распад нужен, как правило, для удержания уровня глюкозы в процессе пищеварения. При длительном голодании содержание гликогена понижается почти до нуля и снова синтезируется во время пищеварения.
Если у организма повышается потребность в глюкозе — гликоген начинает распадаться. Механизм преобразования происходит, как правило, между приемами пищи, и ускоряется при мышечных нагрузках. Голодание (отсутствие приема пищи в течение не менее 24 часов) приводит к практически полному распаду гликогена в печени. Но при регулярном питании его запасы полностью восстанавливаются. Подобное аккумулирование сахара может существовать очень долго, до возникновения потребности в распаде.
Глюконеогенез – процесс синтеза глюкозы из неуглеводных соединений. Его главная задача — удержание стабильного содержания углеводов в крови при недостатке гликогена или тяжёлой физической работе. Глюконеогенез обеспечивает продукцию сахара до 100 грамм в сутки. В состоянии углеводного голода организм способен синтезировать энергию с альтернативных соединений.
Для использования пути гликогенолиза при необходимости получения энергии нужны следующие вещества:
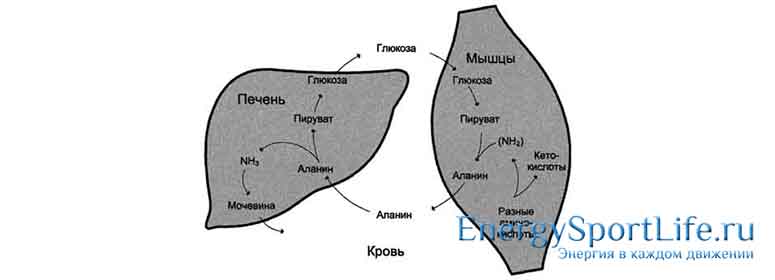
- Лактат (молочная кислота) – синтезируется при распаде глюкозы. После физических нагрузок возвращается в печень, где снова преобразуется в углеводы. Благодаря этому молочная кислота постоянно участвует в образовании глюкозы;
- Глицерин – результат распада липидов;
- Аминокислоты – синтезируются при распаде мышечных белков и начинают участвовать в образовании глюкозы при истощении запасов гликогена.
Основное количество глюкозы производится в печени (более 70 грамм в сутки). Главной задачей глюконеогенеза является снабжение сахаром мозга.
В организм попадают углеводы не только в виде глюкозы — это может быть и манноза, содержащаяся в цитрусовых. Манноза в результате каскада биохимических процессов преобразуется в соединение, подобное глюкозе. В этом состоянии она вступает в реакции гликолиза.
Путь синтеза и распада гликогена регулируется такими гормонами:
- Инсулин – гормон поджелудочной железы белковой природы. Он понижает содержание сахара в крови. В целом особенностью гормона инсулина является влияние на обмен гликогена, в противоположность глюкагону. Инсулин регулирует дальнейший путь преобразования глюкозы. Под его влиянием происходит транспортировка углеводов в клетки организма, а из их избытков — образование гликогена;
- Глюкагон – гормон голода – вырабатывается поджелудочной железой. Имеет белковую природу. В противоположность инсулину, ускоряет распад гликогена, и способствует стабилизации уровня глюкозы в крови;
- Адреналин – гормон стресса и страха. Его выработка и выделение происходят в надпочечниках. Стимулирует выброс избытка сахара из печени в кровь, для снабжения тканей «питанием» в стрессовой ситуации. Так же, как и глюкагон, в отличие от инсулина, ускоряет катаболизм гликогена в печени.
Перепад количества углеводов в крови активирует производство гормонов инсулина и глюкагона, смену их концентрации, что переключает распад и образование гликогена в печени.
Одной из важных задач печени является регулирование пути синтеза липидов. Липидный обмен в печени включает производство разных жиров (холестерина, триацилглицеридов, фосфолипидов, и др.). Эти липиды поступают в кровь, их присутствие обеспечивает энергией ткани организма.
Печень непосредственно участвует в поддержании энергетического баланса в организме. Ее заболевания способны привести к нарушению важных биохимических процессов, в результате чего будут страдать все органы и системы. Необходимо тщательно следить за своим здоровьем и при необходимости не откладывать визит к врачу.
источник
10. «Ветвящий фактор» способствует переносу концевых блоков на внутренний остаток глюкозы с образованием -1,6гликозидной связи.
11. В постабсорбтивном периоде в ответ на повышение потребности организма, гликоген распадается фосфоролитическим путем с образованием глюкозо-1-фосфата и превращающегося в глюкозо-6-фосфат и далее фрукто-6-фосфат и фруктозо-1-6-дифосфата.
На этом заканчивается активация глюкозы, которая идет с затратой 1 (из гликогена) или 2 молекул АТФ (из свободной глюкозы).
12. Альдолаза расщепляет гексозу на две триозы с образованием 2-х молекул глицеринового альдегида, который окисляется дегидрогеназой в 3-фосфоглицерат. При этом в анаэробных условиях субстратным фосфорилированием образуется АТФ2 (учитывая коэффициент 2).
13. В дальнейшем глицериновая кислота превращается в пируват с энергетическим выигрышем 2 молекулы АТФ.
14. В анаэробных условиях восстановленный НАДН + Н + , образованный при окислении глицеринового альдегида восстанавливает ПВК в лактат. Это анаэробный гликолиз, обеспечивающий организм энергией при нехватке кислорода, в первую минуту мышечной работы.
15. Распад гликогена и его синтез одновременно в клетке не идет, а зависит от ритма питания и инсулин/глюкагон – индекса. При гипергликемии секретируется инсулин, активирующий фосфатазы, отщепляющие остатки фосфорной кислоты от гликогенсинтазы (активирует), и фосфорилазы (пассивирует). При снижении глюкозы в крови секретируется из — клеток поджелудочной железы глюкагон, который по аденилат-циклазной системе фосфорилирует фосфорилазу, активируя ее и гликогенсинтазу, которая становится неактивной.
16. Гликогенозы и агликогенозы – проявления недостаточности распада или синтеза гликогена, как результат дефектов соответствующих ферментов.
Ход работы. Заготавливаем 3 пробирки, добавляя по 1 мл крахмала и 3 пробирки с 1 мл сахарозы. Во все пробирки наливаем ферментные препараты по схеме:
источник
ЗАНЯТИЕ 5. ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ УГЛЕВОДНОГО И ЛИПИДНОГО ОБМЕНОВ
1. Гормональная регуляция углеводного обмена.
2. Причины и последствия нарушений гормональной регуляции углеводного обмена.
3. Гормональная регуляция липидного обмена.
4. Причины и последствия нарушений гормональной регуляции липидного обмена.
Гормональная регуляция углеводного обмена.
2. Причины и последствия нарушений гормональной регуляции углеводного обмена.
Обмен углеводов представляет собой систему непрерывных процессов образования, транспорта, поддержания на оптимальном уровне концентрации в крови и распада углеводов. Углеводы человек получает с пищей в виде сахаров (моно-, олиго- и полисахаридов). В процессе переваривания в ЖКТ всех видов углеводов они превращаются в глюкозу, содержание которой в крови – жизненно важная константа. Углеводы служат важнейшим источником энергии (единственным для ЦНС), а также необходимы для пластических функций.
Запасание углеводов в организме происходит в виде гликогена. Образование гликогена из глюкозы начинается с процесса фосфорилирования ее с помощью ферментов глюкокиназы (в печени) и гексокиназы (в других тканях) с образованием глюкозо-6-фосфата (Г-6-Ф). Основная часть глюкозы, пройдя ряд преобразований и включаясь в цикл Кребса, используется для синтеза АТФ в процессе окислительного фосфорилирования.
Количество глюкозы в крови, оттекающей от печени, зависит в основном от двух взаимосвязанных процессов: гликолиза и глюконеогенеза, которые в свою очередь регулируются ключевыми ферментами фосфофруктокиназой и фруктозо-1,6-бисфосфатазой. Активность этих ферментов регулируется гормонами.
Регуляция уровня глюкозы в крови осуществляется с помощью функциональной системы саморегуляции, которая включает в себя множество нервных и гуморальных механизмов. Главным нервным центром регуляции уровня глюкозы в крови является гипоталамо-гипофизарная система, которая реализует свои эфферентные влияния через симпатический и парасимпатический отделы ВНС и через эндокринную систему.
Регуляция концентрации глюкозы в крови происходит двумя путями (рисунок 1):
1) регуляция по принципу отклонения параметра от нормальных значений. Нормальная концентрация глюкозы в крови составляет 3.3 – 5.55 ммоль/л. Регуляция концентрации глюкозы в крови в зависимости от ее концентрации осуществляется двумя гормонами с противоположными эффектами – инсулином и глюкагоном;
2) регуляция по принципу возмущения – эта регуляция не зависит от концентрации глюкозы в крови, а осуществляется в соответствии с необходимостью увеличения уровня глюкозы в крови в различных, как правило, стрессирующих ситуациях. Гормоны, увеличивающие уровень глюкозы в крови, поэтому называются контринсулярными. К ним относятся: глюкагон, адреналин, норадреналин, кортизол, тиреоидные гормоны, соматотропин.
Рисунок 1–Гормональная регуляция уровня глюкозы в крови
Инсулин синтезируется β-клетками поджелудочной железы. Он представляет собой полипептид, состоящий из двух пептидных цепей: α-цепь, состоящая из 21 аминокислотного остатка, соединена дисульфидным мостиком с β-цепью, состоящей из 30 аминокислотных остатков. Инсулины животных разных видов лишь слегка различаются по аминокислотной последовательности и обладают одинаковым биологическим действием.
Основным стимулом выброса инсулина является повышение уровня глюкозы в крови, а также аминокислоты, свободные жирные кислоты, энтерогормоны, действие их усиливают ионы кальция и парасимпатическая нервная система. Главным стимулятором выброса инсулина является глюкоза, поступившая в организм внутривенно или в составе пищи. Гормоны ЖКТ (гастрин, холицистокинин-панкриозимин) усиливают выброс инсулина на глюкозу. Ингибиторами секреции инсулина выступают: соматостатин, простагландины, адреналин, симпатическая нервная система.
Инсулин является единственным физиологическим гормоном, снижающим уровень глюкозы в крови, составляющей в норме 3,3–5,55 ммоль/л. Под влиянием инсулина увеличивается поглощение глюкозы почти всеми клетками тела, и ее концентрация в крови опять снижается.
Биосинтез. Инсулин синтезируется в β-клетках поджелудочной железы в виде препроинсулина, на N-конце которого находится концевая сигнальная последовательность из 23 аминокислот, служащая проводником всей молекулы в полость эндоплазматической сети. Здесь концевая последовательность сразу отщепляется и проинсулин транспортируется в аппарат Гольджи. На данном этапе в молекуле проинсулина присутствуют А-цепь, В-цепь и С-пептид (англ. connecting – связующий). В аппарате Гольджи проинсулин упаковывается в секреторные гранулы вместе с ферментами, необходимыми для «созревания» гормона. По мере перемещения гранул к плазматической мембране образуются дисульфидные мостики, вырезается связующий С-пептид (31 аминокислота) и формируется готовая молекула инсулина. В готовых гранулах инсулин находится в кристаллическом состоянии в виде гексамера, образуемого с участием двух ионов Zn 2+ .
Механизм действия инсулина. Действие инсулина на клетки-мишени начинается после его связывания со специфическими димерными мембранными рецепторами (рисунок 2), при этом внутриклеточный домен рецептора обладает тирозинкиназной активностью. Инсулин-рецепторный комплекс не только передает сигнал внутрь клетки, но и частично путем эндоцитоза поступит внутрь клетки к лизосомам. Под влиянием лизосомальной протеазы инсулин отщепляется от рецептора, при этом последний либо разрушается, либо возвращается к мембране и вновь встраивается в нее. Многократное перемещение рецептора от мембраны к лизосомам и обратно к мембране носит название рециклизация рецептора. Процесс рециклизации важен для регуляции количества инсулиновых рецепторов, в частности обеспечения обратной зависимости между концентрацией инсулина и количеством мембранных рецепторов к нему. Образование инсулин-рецепторного комплекса активирует тирозинкиназу, запускающую процессы фосфорилирования внутриклеточных белков. Происходящее при этом аутофосфорилирование рецептора ведет к усилению первичного сигнала. Инсулин-рецепторный комплекс вызывает активирование фосфолипазы С, образование вторичных посредников инозитолтрифосфата и диацилглицерола, активацию протеинкиназы С, ингибирование цАМФ. Участие нескольких систем вторичных посредников объясняет многообразие и различия эффектов инсулина в разных тканях.
Рисунок 2 — Механизм действия инсулина на клетку-мишень
Все эффекты инсулина по скорости их реализации подразделяют на 4 группы:
1. очень быстрые (через несколько секунд) — гиперполяризация мембран клеток (за исключением гепатоцитов), повышение проницаемости для глюкозы, активация Na/K-АТФазы, входа К + и удаление Na + , подавление Са 2+ -насоса и задержка Са 2+ ;
2. быстрые эффекты (в течение нескольких минут) — активация и торможение различных ферментов, усиливающих анаболические процессы;
3. медленные процессы (в течение нескольких часов) — повышенное поглощение амиминокислот, изменение синтеза РНК и белков-ферментов;
4. очень медленные эффекты (от часов до суток) — активация митогенеза и размножения клеток.
Влияние инсулина на обмен углеводов:
– активирует гликогенсинтетазу, стимулируя тем самым синтез гликогена из глюкозы, т.е. интенсифицирует гликогенез;
– активирует гексо- и глюкокиназу, запуская таким образом процесс фосфорилирования глюкозы — ключевую биохимическую реакцию, стоящую в начале пути как анаэробного, так и аэробного расщепления углеводов;
– активирует фосфофруктокиназу, обеспечивая фосфорилирование фруктозо-6-фосфата, что играет важную роль как в процессах гликолиза, так и глюконеогенеза;
– ингибирует фосфоэнолпируваткарбоксикиназу, т.е. тем самым тормозит ключевую реакцию глюконеогенеза — превращение пирувата в фосфоэнолпируват;
– активирует синтез уксусной кислоты из лимонной в цикле Кребса;
– является необходимым для транспорта глюкозы через клеточную мембрану, в особенности в мышцах и жировой ткани.
Действие инсулина на обмен глюкозы в печени.
Печень — это один из наиболее важных органов тела, запасающих глюкозу. Глюкоза может свободно диффундировать в клетки печени и выходить из них, когда ее содержание в крови снижается. В клетках печени глюкоза под влиянием инсулина превращается в гликоген, и ее содержание в крови снижается.
Биохимические эффекты действия инсулина:
ü активация фермента глюкокиназы, катализирующей фосфорилирование глюкозы, которая поступает в клетки печени;
ü активация фосфофруктокиназы и гликогенсинтетазы, катализирующих полимеризацию фосфорилированной глюкозы с образованием гликогена;
ü ингибирование ферментов, расщепляющих гликоген (фосфорилазы), благодаря чему высокий уровень инсулина способствует консервации гликогена.
За счет быстрого синтеза гликогена и подавления гликогенолиза концентрация глюкозы в крови, повышающаяся после приема пищи, быстро возвращается к нормальному уровню. В результате удаляется основной стимул секреции инсулина, и содержание последнего в крови также нормализуется. Когда организму требуется энергия в промежутках между приемами пища, гликоген опять превращается в глюкозу. Концентрация инсулина в крови в этот период очень мала. Образующаяся при этом глюкоза может свободно выходить из клетки путем диффузии. Таким образом, поддерживается постоянный уровень глюкозы в крови между приемами пищи. При нормальном питании около 60% глюкозы, потребляемой человеком с пищей, временно запасается в печени, с тем, чтобы быстро высвобождаться за счет расщепления гликогена.
Действие инсулина на обмен глюкозы в мышечных клетках.
При низком содержании инсулина в крови мышечные клетки в норме непроницаемы для глюкозы и всю необходимую энергию получают за счет окисления жирных кислот.
Увеличение концентрации инсулина, вызванное повышением уровня глюкозы в крови после приема пищи, делает мышечные клетки проницаемы для глюкозы, которая используется затем в качестве источника энергии. Однако при очень высокой мышечной активности мембраны клеток становятся проницаемы для глюкозы и в отсутствие инсулина. В этом случае потребность работающей мышцы в глюкозе как энергетическом субстрате удовлетворяется даже при базальном уровне инсулина. Когда мышца находится в неактивном состоянии, в ней сразу после приема пищи, т.е. при высоких концентрациях инсулина и глюкозы, тоже образуется и сохраняется небольшое количество гликогена. При острой необходимости этот гликоген опять превращается в глюкозу, которая используется мышечными клетками. Как правило, глюкоза не выделяется обратно в кровь и не играет никакой роли в регуляции уровня сахара в крови после приема пищи. Связываясь с рецептором на поверхности мышечных клеток, инсулин активирует механизм транспорта глюкозы через мембрану.
Обмен глюкозы в нервных клетках. Клетки ЦНС свою довольно высокую потребность в энергии почти целиком покрывают за счет глюкозы, причем ее потребление не зависит от инсулина. Он не влияет на проницаемость мембран для глюкозы и не активирует ферментные системы этих клеток. Тот факт, что ЦНС получает необходимую ей энергию только за счет окисления глюкозы, позволяет понять, почему снижении концентрации последней в крови ниже критического уровня может привести к гипогликемическому шоку с помутнением сознания или даже комой.
Большинство других клеток тела отвечает на инсулин подобно мышечным клеткам.
Поступление глюкозы в клетки из кровотока происходит путем облегченной диффузии при участии специальных белков-переносчиков — ГЛЮТ (глюкозные транспортеры). ГЛЮТ обнаружены во всех тканях. Существует несколько изоформ ГЛЮТ, которые различаются по локализации и сродству к глюкозе. ГЛЮТ пронумерованы в порядке их обнаружения.
Дата добавления: 2018-04-15 ; просмотров: 416 ; ЗАКАЗАТЬ РАБОТУ
источник
Расщепление и синтез гликогена осуществляют различные ферменты.
Расщепление гликогена с образованием глюкозо-1-фосфата катализирует гликоген-фосфорилаза (рис. 5). А синтез гликогена происходит при участии других ферментов.
Основные этапы синтеза гликогена следующие.
1. На первом этапе из свободной глюкозы образуется глюкозо-6-фосфат:
АТФ + Глюкоза > Глюкозо-6-фосфат + АДФ
2. Затем из глюкозо-6-фосфата образуется глюкозо-1-фосфат. Эта реакция обратима.
3. Следующий этап является ключевым. В реакции катализируемой глюкозо-1-фосфат-уридилтрансферазой образуется уридилдифосфатглюкоза (UDP-глюкоза):
UТP + Глюкозо-1-фосфат > UDP-глюкоза + РРi.
4. Далее гликоген-синтаза катализирует перенос гликозильных групп от UDP-глюкозы на молекулу гликогена с образованием альфа(1-4)-связи.
5. Образование боковой цепи гликогена катализирует «ветвящий» фермент гликозил-(4-6)-трансфераза.
В организме человека, как и животных, гликоген синтезируется практически во всех тканях, но больше всего в печени и скелетных мышцах.
Регуляция расщепления и синтеза гликогена также взаимосвязана
Также как гликолиз и глюконеогенез, расщепление и синтез гликогена регулируются взаимосвязано.
Если гликоген-фосфорилаза активируется, то гликоген-синтаза ингибируется, и наоборот.
Регуляцию этих ферментов в печени в конечном счете осуществляют гормоны: инсулин и контринсулярные гормоны, например, адреналин и глюкагон. Инсулин ингибирует распад и стимулирует синтез гликогена.
Контринсулярные гормоны стимулируют расщепление гликогена. Некоторые контринсулярные гормоны проявляют селективность по отношению к различным органам и тканям. Например, глюкагон стимулирует расщепление гликогена только в печени, но не в скелетных мышцах.
Гликогенозы. Ряд наследственных болезней связан с нарушением обмена гликогена. Эти болезни получили название гликогенозов. Они возникают в связи с дефицитом или полным отсутствием ферментов, катализирующих процессы распада или синтеза гликогена, и характеризуются избыточным его накоплением в различных органах и тканях (табл. 10.2).
Гликогеноз I типа (болезнь Гирке) встречается наиболее часто, обусловлен наследственным дефектом синтеза фермента глюкозо-6-фосфатазы впечени и почках. Болезнь наследуется по аутосомно-рецессивному типу. Патологические симптомы появляются уже на первом году жизни ребенка: увеличена печень, нередко увеличены почки. В результате гипогликемии появляются судороги, задержка роста, возможен ацидоз. В крови – повышенное количество лактата и пирувата. Введение адреналина или глюка-гона вызывает значительную гиперлактатацидемию, но негипергликемию, так как глюкозо-6-фосфатаза в печени отсутствует и образования свободной глюкозы не происходит.
57. Регуляция обмена углеводов и поддержания физиологического уровня глюкозы в крови. Характеристика гормонов и механизм их действия. Гипо- и гипергликемии.
. Гормоны. К гормонам, которые влияют на углеводный обмен, принадлежат пептиды инсулин иглюкагон, глюкокортикоид кортизол и катехоламин адреналин (см. сс. 362, 368). Инсулининдуцирует (см. с. 120) синтез de novo гликоген-синтазы [1], а также некоторых ферментов гликолиза [3, 5, 7]. Одновременно инсулин подавляет синтез ключевых ферментов глюконеогенеза (репрессия,[4, 6, 8, 9]). Глюкагон как антагонист инсулина действует в противоположном направлении: индуцирует ферменты глюконеогенеза [4, 6, 8, 9] и репрессирует пируваткиназу [7], ключевой фермент гликолиза. Другие аффекты глюкагона основаны на взаимопревращении ферментов и опосредованы вторичным мессенджером цАМФ (сАМР, см. с. 114). По этому механизму тормозится синтез гликогена [1] и активируется расщепление гликогена [2]. Подобным образом действует и адреналин. Торможение пируваткиназы [7] глюкагоном также обусловлено взаимопревращением ферментов.
Глюкокортикоиды, прежде всего кортизол (см. с. 362), индуцируют все ключевые ферменты глюконеогенеза [4, 6, 8, 9]. Одновременно они индуцируют ферменты деградации аминокислот и обеспечивают тем самым глюконеогенез исходными соединениями.
Метаболиты. Высокие концентрации АТФ (АТР) и цитрата тормозят гликолиз путем аллостерической регуляции фосфофруктокиназы. Кроме того, АТФ тормозит пируваткиназу. Ингибитором пируваткиназы является ацетил-КоА. Все эти метаболиты образуются при распаде глюкозы (торможение конечным продуктом). АМФ (AMP), сигнал дефицита АТФ, активирует расщепление гликогена и тормозит глюконеогенез.
Гипогликемия. Нередко гипогликемия связана с понижением функций тех эндокринных желез, повышение функций которых приводит, как отмечалось, к гипергликемии. В частности, гипогликемию можно наблюдать при гипофизарной кахексии, аддисоновой болезни, гипотиреозе. Резкое снижение уровня глюкозы в крови отмечается при аденомах поджелудочной железы вследствие повышенной продукции инсулина β-клетками панкреатических островков. Кроме того, гипогликемия может быть вызвана голоданием, продолжительной физической работой, приемом β-ганглиоблока-торов. Низкий уровень глюкозы в крови иногда отмечается при беременности, лактации.
Гипогликемия может возникнуть при введении больным сахарным диабетом больших доз инсулина. Как правило, она сопровождает почечную глюкозурию, возникающую вследствие снижения «почечного порога» для глюкозы.
58. Особенности обмена глюкозы в различных тканях (мышцы, эритроциты, мозг, жировая ткань, печень). Зависимость путей использования глюкоза от ритма и характера питания.
ОСОБЕННОСТИ И ЗНАЧЕНИЕ ГЛИКОЛИЗА В ЭРИТРОЦИТАХ 1. Генерация АТФ. АТФ используется для 1) активного транспорта катионов через мембрану, 2) сохранения целостности мембраны и формы эритроцитов. 2. В процессе гликолиза генерируется НАДН2, который является: 1) кофактором метгемоглобинредуктазы — фермента, катализирующего переход мет-Hb в Hb; этот процесс предотвращает накопление мет-Hb (кофактором может являться и НАДФН2); 2) кофактором ЛДГ (лактатдегидрогеназы); 3) поставщиком протонов для супероксиддисмутазной реакции. 3. В процессе гликолиза 1,3-дифосфоглицерат (1,3-ДФГ) превращается в 2,3-ДФГ. На этот процесс расходуется 20-25% глюкозы. 2,3-ДФГ — активная отрицательно заряженная молекула. В эритроцитах периферической крови образует солевую связь с Hb, уменьшает его сродство к кислороду, что обеспечивает переход кислорода в клетки тканей. В капиллярах легких Hb освобождается от 2,3-ДФГ и приобретает способность акцептировать кислород. ПФП — ГЛАВНОЕ НАЗНАЧЕНИЕ — генерация восстановленного кофактора НАДФН2, который используется в эритроцитах для восстановления глутатиона при участии глутатионредуктазы, поставляет протоны для супероксидодисмутазной реакции, хотя и слабо, но используется мет-Hb-редуктазой для восстановления мет-Hb в Hb. Промежуточный продукт ПФП — 3-ФГА (3-фосфоглицериновый альдегид) используется в процессе гликолиза, в том числе и для синтеза 2,3-ДФГ.
Глюкоза высвобождается из печени в промежутках между приемами пищи. Если уровень глюкозы в крови начинает снижаться до нижнего предела в промежутках между приемами пищи, это приведен к ряду изменений и послужит поводом для высвобождения глюкозы из печени в кровоток. 1. Снижение уровня глюкозы приводит к снижению секреции инсулина поджелудочной железой.
2. Отсутствие инсулина приведет к изменению направления реакций, нацеленных на создание запаса гликогена, главным образом к остановке дальнейшего синтеза гликогена в печени и предупреждению поступления глюкозы в печень из крови.
3. Отсутствие инсулина (параллельно с увеличением глюкагона, что будет рассмотрено далее) активирует фермент фосфорилазу, расщепляющую гликоген до глюкозофосфата.
4. Фермент глюкофосфатаза, ингибируемый инсулином, при отсутствии инсулина активируется и приводит к отщеплению фосфатного радикала от глюкозы, что позволяет свободной глюкозе вернуться в кровь.
Таким образом, печень забирает глюкозу из крови, когда в крови возникает ее избыток в связи с приемом пищи, и возвращает ее в кровь, когда концентрация глюкозы снижается в промежутках между приемами пищи. Обычно около 60% глюкозы пищи запасается таким способом в печени и в последующем возвращается в кровь. Инсулин обеспечивает превращение избытка глюкозы в жирные кислоты и ингибирует глюконеогенез в печени.
Цель мышечной клетки – наиболее эффективно использовать поступающую глюкозу для образования АТФ, необходимого для осуществления механической работы – сокращения. В состоянии покоя значительные количества глюкозы резервируются в форме гликогена. Цитоплазма мышечных клеток содержит в высоких концентрациях ферменты гликолиза, а изобилие митохондрий обеспечивает эффективный распад продуктов гликолиза через путь лимонной кислоты и цепь переноса электронов. Лишь в условиях крайнего утомления эти аэробные процессы е справляются с накоплением лактата.
В мышцах идет гликогенез, мышца осуществляет лишь немногие синтетические функции. Ключевые ферменты глюконеогенеза в мышцах отсутствуют, и глюконеогенез не идет. Для востановительных синтезов в мышце НАДФ . Н не требуется, и фосфоглюконатный путь почти не функционирует.
Обмен углеводов в мышцах обеспечивает создание тканевых запасов гликогена в состоянии покоя и использование этих запасов, а также поступающей глюкозы при напряженной работе; основные энергетические потребности всех типов мышц удовлетворяются главным образом за счет окисления продуктов обмена жиров. Ни медленно сокращающаяся гладкая мышечная ткань, ни сердечная мышца не потребляют глюкозу в значительной мере. Во время напряженной работы сердце обеспечивает себя лактатом для окисления.
источник