1. Печень синтезирует заменимые аминокислоты из углеводов и ЖК.
2. Печень синтезирует тканевые и сывороточные белки: все альбумины, большинство (75-90%) α-глобулинов, 50% β-глобулинов (фибриноген, протромбин, проконвертин, проакцелерин) и немного γ-глобулинов (клетки Купфера).
В печени образуется много тканевых ферментов, которые имеют диагностическое значение: ЛДГ, АСТ, АЛТ, транскетолаза, глутаматдегидрогеназа, холинэстераза, щелочная фосфотаза.
Печень синтезирует ферменты плазмы крови: ЛХАТ, ЛПЛ, пептидный гормон ангиотензиноген.
Печень синтезирует специфические азотсодержащие соединения: холин, креатин.
3. Печень гидролизует тканевые и сывороточные белки, пептидные гормоны до АК.
4. Печень дезаминирует аминокислоты. Образующиеся кетокислоты идут в реакции глюконеогенеза, синтеза кетоновых тел.
5. Печень в орнитиновом цикле нейтрализует аммиак с образованием мочевины.
6. Печень осуществляет катаболизм нуклеотидов до пуриновых и пиримидиновых оснований. Пурины потом превращаются в мочевую кислоту, которая затем выделяется почками.
Приобретенные (гепатит, цирроз, опухоли и т.д.) и наследственные заболевания печени (фенилкетонурия, алкаптонурия, тирозинемии) могут вызывать нарушения обмена азотсодержащих соединений.
Для оценки участия печени в обмене азотсодержащих соединений в плазме крови определяют концентрацию свободных АК, общего белка, белковые фракции, протромбиновый индекс, соотношение мочевина/аммиак, проводят нагрузку метионином, диспротеинемические тесты.
Концентрация аммиака в плазме крови в норме 19-43мкмоль/л. Концентрация аммиака повышается при тяжелых паренхиматозных поражениях печени, при портоковальном шунтировании. Может привести к развитию печеночной комы.
Концентрация мочевины в плазме крови в норме 4,2-8,3ммоль/л. Снижение уровня мочевины наблюдается при гепатите, циррозе, острой дистрофии, токсическом поражении печени фосфором, мышьяком и др. ядами.
Концентрация свободных аминокислот в плазме крови в норме 48-68мг/л. Уровень свободных аминокислот (цистеин, метионин, тирозин и глутамат) (и уровень остаточного азота в крови) повышается при тяжелых поражениях печеночной паренхимы, особенно при массивном ее распаде. Фенилаланин и его кетопроизводные повышены в крови при фенилкетонурии. Гомогентизиновая кислота накапливается в организме при алкаптонурии. Повышение тирозина в крови наблюдается при тирозинемиях.
Концентрация общего белка в плазме крови в норме 70-90г/л. Снижение общего белка происходит при циррозе, гепатите, раке печени, токсическом поражении печени.
Концентрация альбуминов в плазме крови в норме 56,5-66,5% от общего количества белка.
Снижение альбуминов происходит при хронических заболеваниях печени: гепатите, циррозе, опухолях печени.
Концентрация α-глобулинов в плазме крови в норме 7,6-14,2% от общего количества белка. Увеличение α-глобулинов в сыворотке крови характерно для острых воспалительных процессов, т.к. в данную фракцию входят белки острой фазы (с-реактивный белок, α1-антитрипсин, α2-макроглобулин и др.). Содержание α-глобулинов может увеличиваться также при обострениях хронических заболеваний.
Концентрация γ-глобулинов в плазме крови в норме 12,8-19,0% от общего количества белка. Содержание γ-глобулинов увеличено при хронических патологических состояниях, связанных с интенсификацией иммунных процессов, т.к. эта фракция состоит главным образом из иммуноглобулинов.
Альбумино-глобулиновый индекс в норме равен 1,5-2,0. Альбумино-глобулиновый индекс снижается при циррозе печени и нефротическом синдроме.
Протромбиновый индекс — отношение стандартного протромбинового времени к протромбиновому времени у обследуемого пациента, выраженное в процентах. В норме он 80-110%. Так как печень синтезирует белки свертывания крови, протромбиновый индекс снижается при развитии печеночной недостаточности.
В организм вводят метионин натощак перорально (50мг/кг). Определяют концентрацию метионина и цистеина в крови и моче натощак, и после нагрузки через каждые 2 часа в течение 12 часов. В норме максимум повышения через 2 часа, нормализация через 6. При печеночной недостаточности максимум превышает норму в 8-10 раз, время циркуляции 10-12 часов.
Диспротеинемические тесты (тимоловая проба, сулемовая проба, проба Вельтмана)
Тимоловая проба (ТП) — осадочная проба, которая фиксирует дис- и парапротеинемию по изменению соотношения альбуминов и β, γ- глобулинов, липопротеидов, фосфолипидов и по появлению в сыворотке крови высокомолекулярных аномальных белков.
Принцип метода: При взаимодействии сыворотки крови с тимоло-вероналовым буфером появляется помутнение вследствие образования глобулин-холестерин-липопротеид-тимол-фосфолипидного комплекса. Его интенсивность связана с количеством и % соотношением отдельных фракций.
Проба не специфична, дает положительный (+) ответ при острых и хронических воспалительных процессах протекающих в различных органах и тканях (печень, почки, легкие, соединительная ткань и т.д.).
ТП (+) — при острых вирусных и хронических токсических гепатитах, деком-пенсированном циррозе, раке и его метастазах в печень, при печеночной желтухе.
ТП (-) при надпеченочной и подпеченочной желтухе (без цитолиза).
источник
11.Источниками большей части протеинов системы комплемента являются не только макрофаги, моноциты, но и гепатоциты.
12.В печени активно протекает метаболизм аминокислот (схема 5). Основная масса поступающих или образовавшихся с помощью транс-аминирования и других реакций (в которых участвует тетрагидрофолиевая кислота — ТГФК) аминокислот затрачивается на синтез различных специфических и неспецифических белков (см. выше).
Другая часть идет на синтез самых разных низкомолекулярных соединений. Так, гликогенные аминокислоты могут служить источниками не только глюкозо-6-фосфата (см. выше), но и глицеральдегид-3-фосфата, судьба которого имеет несколько направлений, в том числе может закончиться образованием глицерол-1-фосфата (см. выше). Из кетогенных аминокислот, как отмечено выше, синтезируются кетоновые тела.
Но в гепатоцитах отдельные аминокислоты подвергаются специфическим преобразованиям:
А) из серосодержащих аминокислот образуется таурин, который позднее включается в парные жёлчные кислоты (таурохолевая, тауродезоксихолевая), а также может служить антиоксидантом, связывая гипохлорит анион, стабилизировать мембраны клеток;
Б) в гепатоцитах происходит активация метионина, который в виде S-аденозилметионина служит источником метильных групп в следующих реакциях:
а) окончание генеза креатина:

б) синтез холина для холинфосфатидов (липотропных веществ):

13.По наличию гема (субстраты для его синтеза — сукцинил КоА и аминокислота глицин) печень занимает 2 место за эритроцитами, так как это соединение является облигатным компонентом цитохрома Р450 (гидроксилирующего ксенобиотики, см. ниже).
14.В печени завершается катаболизм многих азотсодержащих соединений. Все они служат источником аммиака (из –NH2), который при растворении дает сильную щёлочь – гидроксид аммония. Поэтому во всех клетках организма, где он образуется, в ответ начинают работать различные буферные системы, альфа-кетокислоты, которые его нейтрализуют. Но этот промежуточный процесс должен закончиться в печени инактивацией полученных соединений. Подобное химическое явление получило название орнитинового цикла синтеза мочевины (или цикла Кребса I по имени исследователя, описавшего его ключевые звенья) (схема 5).
15.Ароматические азотсодержащие соединения, в первую очередь пуриновые основания, являясь конденсированными гетероциклами, не способны подвергаться распаду. Поэтому после неоднократных гидроксилирований преобразуются в мочевую кислоту (точнее в её соли – ураты). Этот процесс, как и предыдущий, описан только в гепатоцитах.
16.Как известно, разрушение старых и больных эритроцитов осуществляется клетками РЭС, в том числе печени. При этом деградация гема завершается образованием билирубина – потенциально токсического соединения. Где бы ни синтезировался, он должен быть доставлен в гепатоциты для окончательной инактивации. Ключевую роль в этой ситуации играет фермент УДФ-глюкуронилтрансфераза (УДФГ-трансфераза), с помощью которой и получаются относительно растворимые билирубинмоно- и билирубиндиглюкурониды (связанный билирубин), выделяющиеся из организма в составе жёлчи.
При подавляющем большинстве заболеваний внутренних органов, сопровождающихся сдвигами в белковом обмене, обнаруживается гипопротеинемия, носящая обычно вторичный, приобретённыйхарактер. Абсолютную гипопротеинемию, возникающую, как правило, из-за снижения величин альбуминов, обусловливают многочисленные причины (недостаточное поступление белков с пищей, их повышенный распад в организме, потеря с кровью и мочой, перемещение в другие ткани при формировании экссудатов и отёков, генетически детерминированные нарушения в генезе ферментов), а также подавление протеосинтетической функции печени. Последнее наблюдается при паренхиматозных гепатитах и циррозах.
Более половины всего количества белков плазмы (35-55 г/л) приходится на долю альбуминов, которые обновляются достаточно быстро: в течение суток образуется и разрушается 10-16 г подобных соединений. Благодаря значительной концентрации, высокой гидрофильности и небольшим размерам молекул они выполняют важную функцию по поддержанию коллоидоосмотического давления плазмы, тем самым участвуя в обмене воды между кровью и межтканевым пространством.
При содержании указанной фракции протеинов в плазме крови ниже 30 г/л онкотическое давление уменьшается настолько, что вода переходит из внутри- во внесосудистый сектор, что может обусловить возникновение отёков. Определение уровня альбуминов в сыворотке крови играет существенную роль для оценки тяжести течения заболеваний, сопровождающихся гипоальбуминемией, одной из причин которойявляется распад гепатоцитов.
Вторичная гипоальбуминемия наблюдается при альтерациях печени, портальном циррозе, длительной механической желтухе. Снижение цифр данных белков крови при хронических поражениях органа (тяжёлом длительном вирусном гепатите, циррозах печени) имеет прогностическое значение и служит неблагоприятным признаком. При острых повреждениях гепатоцитов определение содержания альбуминов в биологических жидкостях особого значения не имеет.
Для диагностики заболеваний внутренних органов большую значимость приобретает комплексная оценка количественных вариаций всех выявляемых белковых фракций. Принято выделять несколько, нередко разных по патофизиологической природе типов изменений в их спектре, отражающих как дис-, так и парапротеинемии. Отдельные типы электрофореграмм включают следующие сдвиги в профиле сывороточных протеинов (табл. 2):
Таблица 2. Типы протеинограмм, соответствующие определённым видам заболеваний внутренних органов
| № | Тип протеинограммы, соответствующий | Альбу-мины | Глобулины | |||
| α1 | α2 | β | γ | |||
| 1. | Острым воспалительным процессам |    |  |  |  |  |
| 2. | Хроническому воспалению |   |  |  |  |  |
| 3. | Нефротическому симптомокомплексу |    |  |  |  |  |
| 4. | Злокачественным новообразованиям |  |  |  |  |  |
| 5. | Гепатитам |  |  |  |  |  |
| 6. | Циррозам печени |   |  |  |  |  |
| 7. | Обтурационной желтухе |    |  |  |  |  |
Примечание: — значительное увеличение; — умеренное увеличение;



1-й тип протеинограмм характеризуется резким снижением величин альбуминов и возрастанием уровня α-1- и α-2-глобулинов. Такая диспротеинемия обусловлена усиленным синтезом белков острой фазы (α-1- и α-2-глобулинов, составляющих группу гликопротеинов) и подавлением продукции альбуминов в гепатоцитах (вследствие интоксикации, отчасти компенсаторной). Чаще наблюдается при острых воспалительных процессах, а также при обширном свежем инфаркте миокарда, сепсисе, начальной стадии пневмонии, туберкулёзе лёгких, остром полиартрите.
2-й тип протеинограмм отличается умеренным падением доли альбуминов и значительным увеличением концентрации α-2- (нередко α-1-) и γ-глобулинов. Последние усиленно синтезируются системой мононуклеарных фагоцитов. Цифры общего белка и β-глобулинов в крови сохраняются в пределах нормы. Специфический признак – снижение коэффициента альбумины/(α-2- + γ-глобулины) менее 2,2. Встречается при синдроме хронического воспаления (холецистит, поздняя стадия пневмонии, хронические формы туберкулёза лёгких).
В 3-м типе протеинограмм регистрируется значительное уменьшение величин альбуминов, повышение значений α-2- и β-глобулинов при умеренном падении уровня γ-глобулинов. Данный тип изменений свойственен синдрому нарушения функции почечного фильтра.
У 4-го типа протеинограмм выявляется вилка, подобная 3-му типу, только фиксируется подъём количества всех глобулиновых фракций (вследствие их гиперпродукции в ответ на угнетение синтеза альбуминов, обусловленное синдромом интоксикации). Именуется типом злокачественных новообразований.
5-й тип протеинограмм связан с умеренным уменьшением концентрации альбуминов (из-за нарушения протеосинтетической функции гепатоцитов), ростом долей γ-глобулинов (в силу «раздражения» системы мононуклеарных фагоцитов и усиления продукции IgG, IgA, IgM) и менее выраженным накоплением β-фракции. Наблюдается при гепатитах, последствиях токсического повреждения печени. Уровень общего белка крови сохраняется в пределах нормальных границ.
6-й тип протеинограмм отличает глубокая гипоальбуминемия с параллельным падением в классе α-2-глобулинов (из-за глубоких дистрофических повреждений гепатоцитов) при сильном увеличении (отчасти компенсаторном) цифр γ-глобулинов (за счёт IgA, IgG). Обнаруживается при циррозе печени.
7-й тип протеинограмм включает уменьшение содержания альбуминов с небольшим повышением величин α-2-, β- и γ-глобулинов. Встречается при обтурационной желтухе, вызванной наличием камней в общем жёлчном протоке, закупоркой его раковой опухолью, злокачественным новообразованием в головке pancreas (что создаёт механическое препятствие оттоку жёлчи).
2.4. РОЛЬ ПЕЧЕНИ В СУДЬБЕ ВИТАМИНОВ
1.Печень секретирует жёлчь, компоненты которой – соли жёлчных кислот — ответственны за всасывание липовитаминов (А, Д, Е, К, F).
2.Все жирорастворимые и многие из гидровитаминов (В12, фолиевая кислота, В1, В6, РР и др.) способны депонироваться в печени.
3.Особая роль этого органа заключается в том, что в нём происходит активация витаминов:
а) фолиевая кислота с помощью витамина С восстанавливается в тетрагидрофолиевую кислоту (ТГФК);
б) витамины В1 и В6 фосфорилируются в тиаминдифосфат и пиридоксальфосфат соответственно;
в) часть каротинов преобразуется в витамин А под влиянием каротиндиоксигеназы;
г) витамин Д подвергается первому гидроксилированию на пути получения гормона кальцитриола;
д) окислившийся витамин С восстанавливается в аскорбиновую кислоту;
е) витамины РР, В2, пантотеновая кислота включаются в соответствующие нуклеотиды (НАД + , НАД + Ф, ФМН, ФАД, КоА-SH);
ж) витамин К окисляется, чтобы в виде своего пероксида служить коферментом в созревании (посттрансляционной модификации) белковых факторов свёртывания крови.
4.В печени синтезируются белки, выполняющие транспортные функции по отношению к витаминам. Например, ретинолсвязывающий белок (его содержание уменьшается при опухолях), витамин Е-связывающий белок и т.д.
5.Часть витаминов, в первую очередь жирорастворимых, а также продуктов их преобразований выделяется из организма в составе жёлчи.
2.5. ФУНКЦИИ ПЕЧЕНИ В МИНЕРАЛЬНОМ ОБМЕНЕ
1.Печень служит депо различных макро- (К, Na, Ca, Mg, Fe) и микро-(Cu, Mn, Zn, Cо, As, Cd, Pb, Se) элементов.
2.Для накопления железа гепатоциты синтезируют специальный белок – ферритин. В ретикулоэндотелиоцитах печени и селезенки регистрируется водонерастворимый железосодержащий протеиновый комплекс –гемосидерин.
3.В гепатоцитах синтезируется церулоплазмин, который, кроме выше-названных функций, выполняет роль транспортного белка для ионов меди.
4.Трансферрин, обладающий как и церулоплазмин, полифункциональ-ностью, также образуется в печени и используется для переноса в плазме крови только ионов железа. Данный белок необходим для эмбрионального клеточного роста в период формирования печени.
5.В печени ион Zn включается в алкогольдегидрогеназу, необходимую для биотрансформации этанола (см. схему 2).
6.Поступившие в гепатоциты соединения селена преобразуются в Se-содержащие аминокислоты и с помощью специфической т-РНК включаются в различные Se-протеины: глутатионпероксидазу (ГПО), I-йодтиронин-5’—дейодиназу, Se-протеин Р. Последний считают основным транспортёром этого микроэлемента. Дейодиназа, обнаруженная не только в печени, обеспечивает конверсию прогормона тироксина в активную форму – трийодтиронин. Что же касается ГПО, активность этого фермента регистрируется практически во всех тканях, но особенно она велика в гепатоцитах. Как известно, глутатионпероксидаза – ключевой фермент антирадикальной защиты.
7.В печени сера, включённая в аминокислоты, окисляется до сульфатов, которые в виде ФАФС (фосфоаденозилфосфосульфатов) используются в реакциях сульфирования ГАГов, липидов, а также в процессах биотрансформации ксенобиотиков и некоторых эндогенных веществ (примеры продуктов инактивации – скатоксилсульфат, индоксилсульфат).
8.Печень способна служить временным депо воды, особенно при отёках (количество Н2О может составлять до 80 % от массы органа).
2.6. ЗНАЧЕНИЕ ПЕЧЕНИ В РЕГУЛЯЦИИ
1.В гепатоцитах синтезируются белки, транспортирующие гормоны в крови (секс-стероидсвязывающий белок, транскортин, тироксин-связывающий глобулин и др.).
2.Печень – один из немногих органов, где тироксин дейодируется в трийодтиронин (см. выше).
3.Важный гормон, регулирующий обмен Са – кальцитриол начинает синтезироваться из витамина Д в печени (см. выше).
4.ИФР-1 (инсулиноподобный фактор роста), секретируемый клетками печени, регулирует высвобождение гормона роста, подавляя выделение соматолиберина из клеток гипоталамуса и стимулируя работу соматостатина.
5.Под влиянием аминооксидаз в печени происходит окисление катехоламинов.
6.Женские половые гормоны (эстрадиол, эстрон) преобразуются в эстриол.
7.Стероидные гормоны инактивируются, подвергаясь микросомальному окислению, превращаясь затем в глюкурониды или сульфаты (см. ниже).
8.В печени регистрируются специфические гидролазы (вазопрессиназа, инсулиназа), расщепляющие соответствующие гормоны.
При различных недугах печени могут возникать сдвиги с таковыми при синдроме эутироидной патологии (нормальные величины общего и свободного Т4 в сочетании с низким уровнем общего и свободного Т3).
Наиболее характерным для больных циррозом печени является уменьшение концентраций общего и свободного трийодтиронина вследствие подавления активности дейодиназы, локализующейся в гепатоците.
Низкие цифры Т3 (общего и свободного) характеризуют гипотироидный статус, который может служить адаптационной реакцией организма в целях угнетения скорости метаболизма в клетках печени и предохранения функций органа, а также для сохранения общих запасов белков. В последние годы показано, что у пациентов с ЦП развитие гипотироза приводит к улучшению биохимических показателей печени, уменьшению степени декомпенсации.
У больных с острым гепатитом лёгкой или средней тяжести отмечается на фоне нормального уровня свободного тироксина повышение количества общего Т4 вследствие роста содержания тироид-связывающего глобулина, который синтезируется в этот период в числе белков острой фазы. При угрозе развития печёночной недостаточности соотношение свободных Т3 и Т4 отрицательно коррелирует с тяжестью недуга и может иметь прогностическое значение.
При хроническом гепатите без сопутствующих аутоиммунных повреждений величины общего Т4, общего Т3 и тироксин-связывающего глобулина часто повышены, а значения тиротропного гормона и свободного Т4 находятся в пределах нормы.
Принятое в последнее время лечение вирусных гепатитов α-интерфероном создало дополнительный риск возникновения аномалий функций щитовидной железы с индукцией аутоиммунных реакций, образованием антитироидных антител, антител к рецепторам ТТГ.
2.7. БИОТРАНСФОРМАЦИОННАЯ ФУНКЦИЯ ПЕЧЕНИ
Исторически сложилось, что процесс преобразований поступающих в печень ксенобиотиков (лекарств, ядов, продуктов гниения в кишечнике) и метаболитов, доставленных из клеток организма (гормонов, витаминов, билирубина, глутамина, других аминокислот, солей аммония и т.д.) называли термином «обезвреживающая функция». Если же подойти внимательно к этому словосочетанию, то естественно возникает вопрос: разве правильно считать инактивацию гормонов, витаминов и других жизненно важных соединений обезвреживанием? В настоящее время у гепатологов входит в лексику следующий термин: «биотрансформационная функция».
Процесс инактивации для разных веществ различен, определяется особенностями их строения. Например, чтобы обезвредить аммиак, из него синтезируется мочевина, витамин РР метилируется, сульфаниламиды ацетилируются, нитробензол восстанавливается в парааминофенол, этанол окисляется, сердечные гликозиды гидролизуются и т.д.
Для большинства биологически активных соединений, способных преодолеть клеточную мембрану, характерна амфипатичность. Следовательно, чтобы предотвратить их поступление в цитоплазму, необходимо увеличить гидрофильность. Для этих целей в печени в солидных концентрациях локализуются УДФГК, ФАФС, ацетил-КоА, глутамин, глицин, цистеин и некоторые другие аминокислоты, которые вступают во взаимодействие с инативируемыми веществами с образованием так называемых парных соединений, а сам процесс обозначается термином конъюгирование.
Классическим примером подобного обезвреживания могут служить образование растворимого (тем самым нетоксичного) билирубинглюкуронида, получение фенилацетилглутамина (продукта инактивации фенилпирувата – метаболита фенилаланина, накопление которого в необычных количествах провоцирует олигофрению фенилпирувику /фенилкетонурию/). Подобным образом обезвреживаются продукты гниения белков в кишечнике (индол → индоксилсерная кислота, скатол→ скатоксилсерная кислота и т.д.).
Нормальным метаболитом является и гиппуровая кислота, образующаяся в печени по тому же принципу из бензойной кислоты и глицина (на этом основана давняя проба Квика-Пытеля, с помощью которой выясняется антитоксическая функция печени).
Основные преобразования осуществляются в микросомах печени. Стероидные гормоны, подвергаясь микросомальному окислению, инактивируются, превращаясь затем в соответствующие глюкурониды и сульфаты. Под влиянием аминооксидаз преобразуются катехоламины. Ароматические углеводороды окисляются до карбоновых кислот.
Наряду с микросомальным (ключевой акцептор электронов цитохром Р450, а также монооксигеназы, цитохром-с-редуктазы, восстановленный НАДФ), в печени существует также пероксисомальное окисление. Пероксисомы – микротельца, служащие специализированными окислительными органеллами. Они содержат оксидазу мочевой кислоты, лактатоксидазу, оксидазу Д-аминокислот, а также каталазу. Последняя катализирует расщепление пероксида водорода, который образуется при действии вышеназванных оксидаз.
Однако не всегда подобные химические трансформации напрямую обусловливают снижение биологической активности. Иногда развивается прямо противоположный эффект. Хлороформ в печени преобразуется в фосген, этанол в ацетальдегид, тетраэтилсвинец в триэтилсвинец – все образовавшиеся продукты более токсичны, чем их предшественники.
Над использованием уникальных биотрансформационных свойств печени бьются исследователи, пытаясь создать лекарства, которые, проходя по желудочно-кишечному тракту, относятся индифферентно к живущей в нём микрофлоре. Но, попадая в печень и преобразуясь там, они обретают бактериостатическую активность. Цель благородна, но труднодостижима, так как не всегда чётко можно прогнозировать варианты химической трансформации.
Интересно, что всех людей можно разделить на лиц с медленно и быстро работающей печенью. Печень-«флегматик» часто становится жировым депо. Соединения в ней распадаются медленно, не торопясь утилизируются, жир же накапливается. Этот процесс усугубляется у алкоголиков, у больных сахарным диабетом, ожирением. Тем, у кого замедлена биотрансформация, не показана работа на химических предприятиях, в химических лабораториях и т.д.
3. ЛАБОРАТОРНАЯ ДИАГНОСТИКА ЗАБОЛЕВАНИЙ ПЕЧЕНИ
Острая и хроническая патология печени многообразна. Проблема хронических поражений органа является одной из основных и сложных в гастроэнтерологии. Хронические гепатиты включают широкий спектр нозологически самостоятельных диффузных воспалительных заболеваний печени различной этиологии. Их основными этиологическими факторами признаны инфицирование гепатотропными вирусами, действие ксенобиотиков и, в первую очередь, алкоголя и лекарств. В ряде случаев не удаётся установить причину поражения, например, при аутоиммунном гепатите. Кроме того, некоторые недуги органа на определённом этапе их развития имеют ряд общих клинических и морфологических признаков, свойственных гепатитам, что требует проведения дифференциальной диагностики между ними. К
Таблица 3. Основные патогенетические механизмы развития острых и хронических заболеваний печени
| Заболевания | Ведущий патогенетический механизм | |
| 1.Вирусные гепатиты (ВГ) | Острый и хро-нический вирус-ный гепатит В | Цитолиз гепатоцитов связан с активностью Т-киллеров (при наличии НВсоrAg и НВеАg) |
| Острый и хро-нический вирус-ный гепатит С | Прямой цитотоксический эффект вируса, иммунный цитолиз | |
| Острый и хро-нический вирус-ный гепатит Д | Прямой цитотоксический эффект вируса, иммунный цитолиз | |
| 2.Аутоиммун- ный гепатит (АГ) | Первичный билиарный цирроз печени (ПБЦ) | Аутоантитело-зависимая цитотоксич-ность – иммунно-опосредованные некрозы гепатоцитов при АГ или холангиоцитов при ПБЦ |
| 3.Лекарствен-ные и алко-гольные поражения печени | Жировая дистрофия печени без некрозов Острый гепатит, стеатогепатит | Блокада ферментов, участвующих в синтезе липопротеинов, фосфо-липидов и др. (дефицит липотропных факторов) Усиление перекисного окисления липидов (ПОЛ) мембран гепатоцитов с накоплением Н2О2 и свободных ионов кислорода Блокада энзимов, участвующих в биотрансформационной функции печени (цитохрома Р450 и др. микросомальных ферментов) |
| 4.Болезнь Вильсона–Коновалова, гемохроматоз | Усиление ПОЛ Активация фиброгенеза | |
| 5.Циррозы печени | Соответствует этиологическому фак-тору Активация фиброгенеза Аутоантитело-зависимая цитотоксич-ность Дефицит ферментов микросомального окисления |
последним относятся первичный билиарный цирроз печени, склерозирующий холангит, болезнь Вильсона-Коновалова, гемохроматоз, α1-антитрипсиновая недостаточность, ряд наследственных заболеваний, включая тезаурисмозы (болезни накопления), патология органа при беременности, системных и инфекционных поражениях. Основные звенья патогенеза вышеперечисленных страданий указаны в таблице 3.
Клиническая лабораторная диагностика имеет ведущее значение в гепатологии. Биохимические тесты не являются строго специфичными, но по их результатам можно сделать заключение о функциональном состоянии органа, подтвердить повреждение печени, а также судить об активности и тяжести процесса.
В комплексе биохимических исследований остаётся важным изучение ферментного статуса, пигментного обмена, белкового состава сыворотки, осадочных проб и выделительной функции печени.
Доминирующее значение в лабораторной диагностике заболеваний гепатобилиарной системы имеет определение активности энзимов, генез которых осуществляется гепатоцитами и клетками эпителия жёлчных протоков. В клинической практике их условно подразделяют на секреторные, экскреторные и индикаторные.
Секреторные — синтезируются гепатоцитами и у здоровых людей выделяются в плазму, выполняя в ней определённые функции. К ним относят холинэстеразу (ХЭ), церулоплазмин, про- и частично антикоагулянты.
Экскреторные — образуются в печени и частично в других тканях, в том числе, в жёлчных выводных протоках, и в обычных условиях выделяются с жёлчью (щелочная фосфатаза (ЩФ), γ-глутамилтранспептидаза, лейцинаминопептидаза, 5′-нуклеотидаза, β-глюкуронидаза).
Последние достижения клинической энзимологии позволяют условно разделить эти БАВ по локализации на следующие группы:
1) универсально-распространенные ферменты, активность которых обнаруживается не только в печени, но и в других органах – аминотрансферазы, фруктозодифосфатальдолаза (ФДФА);
2) печёночно-специфические (органоспецифические) – энзимы, активность которых исключительно или в максимальной степени регистрируется в печени. К ним относятся уроканиназа, орнитинкарбамоилтрансфераза, аргиназа, фруктозо-1-фосфатальдолаза, сорбитолдегидрогеназа и другие;
3) клеточно-специфические биокатализаторы – преимущественно локализуются в гепатоцитах, в купферовских клетках или холангиоцитах (5′-нуклеотидаза, щелочная фосфатаза, γ-глутамилтранспептидаза);
4) органеллоспецифические – являются маркёрами определённых компартментов гепатоцита: цитоплазматические, митохондриальные, митохондриально-цитоплазматические, лизосомальные (кислая фосфатаза, рибонуклеаза, дезоксирибонуклеаза), микросомальные (глюкозо-6-фосфатаза) (табл.1). Этим ферментам присущи внутриклеточные каталитические эффекты, и они являются наиболее диагностически важными. В физиологических условиях активность некоторых из них (ЛДГ, альдолазы, АлАТ, АсАТ) в плазме крови низкая, а при глубоких повреждениях печени — возрастает.
Таблица 4. Энзимы печени и их компартментализация
| Особенности ферментов | Название | |
| I. | Секреторные энзимы: | ХЭ, церулоплазмин, про- и частично антикоагулянты |
| II. | Экскреторные: | ЩФ, ЛАП, ГГТП, 5′-нуклеотидаза, β-глюкуронидаза |
| 1) универсально-распространённые | Аминотрансферазы, ФДФА | |
| 2) печёночно-специфические (органоспецифические) | Уроканиназа, орнитинкарбамоилтрансфераза, аргиназа, Ф-1-ФА, сорбитолДГ | |
| 3) клеточно-специфические | ЩФ, ГГТП, 5′-нуклеотидаза | |
| 4) органелло-специфические: | АлАТ, АсАТ, ЛДГ, альдолаза, кислая фосфатаза, рибонуклеаза, дезоксирибонуклеаза, глюкозо-6-фосфатаза | |
| а) цитоплазматические | АлАТ, ГГТП, ЛДГ, сорбитолДГ, альдолаза, ЛАП | |
| б) митохондриальные | ГлДГ, карбамоил-фосфатсинтетаза, АсАт | |
| в) митохондриально-цитоплазматические | АсАТ |
Очевидно, что спектр плазменных энзимов в нормальных условиях зависит от их клеточного набора в гепатоците и способности проникновения через клеточную и органоидные мембраны. В зависимости от расположения в клетке их условно можно разделить на цитоплазматические, митохондриальные и митохондриально-цитоплазматические. В таблицах 1, 4 перечислены энзимы и их компартментализация.
Вышеуказанная классификация имеет ряд недостатков, так как некоторые печёночно-специфические энзимы не являются абсолютно характерными для печени. С другой стороны, сывороточная ферментограмма значительно расширяет и детализирует оценку функциональных повреждений гепатоцитов.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
Человек и животные способны синтезировать только 10 из 20 аминокислот, необходимых для синтеза белка, — это заменимые аминокислоты (24.2). Пути биосинтеза этих аминокислот разнообразны, но при этом они обладают одним важным свойством:
(Т) углеродный скелет аминокислот образуется из промежуточных метаболитов гликолиза, пентозофосфатного пути, цикла трикарбоновых кислот.
Синтез заменимых аминокислот осуществляется с помощью весьма простых реакций, протекающих, как правило, в одну или две стадии, которые обеспечивают аминирование углеродного скелета предшественника.
Принято выделять три основных пути биосинтеза аминокислот:
- • прямое аминирование а-кетокислот или ненасыщенных органических кислот;
- • реакции трансаминирования;
- • ферментативные взаимопревращения отдельных аминокислот как заменимых, так и незаменимых.
Предшественники заменимых аминокислот приведены ниже:
На рис. 24.14 приведена схема синтеза девяти заменимых аминокислот, которые могут образовываться из глюкозы. Десятая аминокислота — тирозин — синтезируется путем гидроксилирования незаменимой аминокислоты фенилаланина.
Рис. 24.14. Пути синтеза заменимых аминокислот, образующихся из глюкозы:
ТА — трансаминирование; ГДГ — глутаматдегидрогеназа
Синтез глутамата из а-кетоглутарата путем восстановительного аминиро- вания уже обсуждался, равно как и реакция аминирования глутамата и превращения его в глутамин.
Аланин синтезируется из пирувата путем трансаминирования, чаще всего с глутаматом. Реакция катализируется ферментом глутаматпируватгрансаминазой:
Синтез пролина из глутамата включает следующие превращения: АТФ-за- висимое восстановление до у-полуальдегида; циклизация с отщеплением Н20 и восстановлением НАДФН завершает процесс синтеза пролина:
Тирозин, как отмечалось выше, образуется из незаменимой аминокислоты фенилаланина путем ее гидроксилирования под действием оксигеназы (фе- нилаланин-4-гилроксилаза) за счет прямого присоединения кислорода:
Серин синтезируется из промежуточного продукта гликолиза — 3-фосфо- глицерата. Вначале происходит его окисление до 3-фосфогидропирувата, затем трансаминирование с глутаматом с последующим дефосфорилированием:
Серин является предшественником глицина и цистеина. При синтезе глицина p-углеродный атом серина переносится на тетрагидрофолат (ТГФ) — переносчик одноуглеродных фрагментов:
Эта реакция катализируется ферментом серингилроксиметилтрансферазой. простетической группой которого является пиридоксальфосфат.
Цистеин синтезируется из серина и гомоцистеина (деметилированного метионина), выступающего донором сульфогруппы. Реакции протекают в две стадии и катализируются также пиридоксальфосфатзависимыми ферментами — цистатионсинтазой и цистатиониназой:
источник
Раздел 2. Тема 11. Обмен аминокислот.
Растения и многие виды бактерий содержат ферментные системы, необходимые для синтеза всех требуемых α-кетокислот. Животные утратили способность синтезировать некоторые α-кетокислоты, которые соответствуют незаменимым аминокислотам. Другие α-кетокислоты (соответствующие заменимым аминокислотам) могут образовываться в результате метаболизма иных веществ.
1. Синтез заменимых аминокислот.
В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про. Углеродный скелет этих аминокислот образуется из глюкозы, а α-аминогруппа вводится в соответствующие α-кетокислоты в результате реакций трансаминирования. Универсальным доноромα-аминогруппы служит глутамат.Реакцию трансаминирования катализируют ферменты аминотрансферазы (трансаминазы) с участием кофермента пиридоксальфосфата (ПФ, производное витамина В6). Пиридоксальфосфат является обязательным компонентом активного центра трансаминаз и многих других ферментов, для которых субстратами служат аминокислоты.
Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты:
Эти реакции легко обратимы. При этом происходит образование глутамата.


В сыворотке крови здоровых людей активность этих трансаминаз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся разрушением клеток, приводят к выходу трансаминаз из очага поражения в кровь. Так, уже через 3–5 ч после развития инфаркта миокарда уровень АСТ в сыворотке крови резко повышается (в 20–30 раз). Максимум активности обеих трансаминаз крови приходится на конец первых суток, а уже через 2–3 дня при благоприятном исходе болезни уровень сывороточных трансаминаз возвращается к норме. Напротив, при затяжном процессе или наступлении повторного инфаркта миокарда наблюдается новый пик повышения активности этих ферментов в крови. Этим объясняется тот факт, что в клинике трансаминазный тест используется не только для постановки диагноза, но и для прогноза и проверки эффективности лечения.
При поражениях клеток печени, например, при гепатитах, наблюдается медленное повышение уровня АЛТ в сыворотке. При коронарной недостаточности (стенокардия, пороки сердца и др., кроме инфаркта миокарда) гипертрансаминаземия или не наблюдается, или незначительна. Повышение уровня трансаминаз в сыворотке крови отмечено и при некоторых заболеваниях мышц: при обширных травмах, гангрене конечностей и прогрессивной мышечной дистрофии.
Пара α-кетоглутарат и глутамат широко участвуют в метаболическом потоке азота. Например, с помощью реакций трансаминирования осуществляется «переброска» аминного азота из мышц в печень. В работающей мышце происходит образование аланина из пировиноградной кислоты путем трансаминирования с глутаматом. Аланин поступает в кровь и затем поглощается печенью. В печени происходит обратная реакция, в результате которой образуется пируват, направляемый в глюконеогенез.
Поскольку реакции обратимы, то они играют большую роль как в процессе синтеза аминокислот, так и при их катаболизме. Такие реакции, выполняющие двойную функцию, называют амфиболическими.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Студент — человек, постоянно откладывающий неизбежность. 10168 — 

95.83.2.240 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Печень участвует во всех этапах липидного обмена, начиная с переваривания липидов и заканчивая специфическими метаболическими превращениями отдельных липидных фракций:
синтез желчных кислот и образование желчи;
образование кетоновых тел;
распад и синтез фосфолипидов;
синтез холестерола и образование его эфиров; соотношение эфиры холестерина/свободный холестерин в норме составляет примерно 0,5 – 0,7 %; снижение этого коэффициента до 0,3 – 0,4 % наблюдается при поражениях печени и является неблагоприятным признаком;
основное место синтеза липопротеинов очень низкой плотности и липопротеинов высокой плотности;
гидроксилирование витамина D по 25-му положению.
Печень играет центральную роль в обмене белков и других азотсодержащих соединений. Она выполняет следующие функции:
синтез специфических белков плазмы: — в печени синтезируется: 100 % альбуминов, 75 – 90 % α-глобулинов, 50 % β-глобулинов,
единственный орган, где синтезируются белки свертывающей системы крови – протромбин, фибриноген, проконвертин, проакцелерин;
активно протекают реакции трансаминирования и дезаминирования аминокислот;
биосинтез мочевины происходит исключительно в печени;
образование мочевой кислоты происходит в основном в печени, так как здесь много фермента ксантиноксидазы, при участии которого продукты распада пуриновых оснований (гипоксантин и ксантин) превращаются в мочевую кислоту;
В печени происходит детоксикация различных веществ.
Печень является главным органом, где происходит обезвреживании естественных метаболитов (билирубин, гормоны, аммиак) и чужеродных веществ. Чужеродными веществами, или ксенобиотиками, называют вещества, поступающие в организм из окружающей среды и не используемые им для построения тканей или в качестве источников энергии. К ним относят лекарственные препараты, продукты хозяйственной деятельности человека, вещества бытовой химии и пищевой промышленности (консерванты, красители).
1. Обезвреживание пигментов.
В клетках ретикулоэндотелиальной системы печени протекает катаболизм гема до билирубина, конъюгация билирубина с глюкуроновой кислотой в гепатоцитах и распад в гепатоцитах поступающего из кишечника уробилиногена до непигментных продуктов.
Аммиак – высокотоксичное соединение, особо опасное для мозга. Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины в печени. Мочевина – малотоксичное соединение и легко выводится из организма с мочой.
Печени принадлежит значительная роль в инактивации гормонов. Многие пептидные гормоны гидролизуются в печени при участии протеолитических ферментов. Например, фермент инсулиназа гидролизует пептидные цепи А и В инсулина. Катаболизм адреналина и норадреналина происходит в печени путем дезаминирования моноаминооксидазой, метилирования и конъюгации с серной и глюкуроновой кислотами. Продукты метаболизма выводятся с мочой.
источник
Включение углеродных скелетов аминокислот в цикл лимонной кислоты.
Синтез аминокислот
Заменимые аминокислоты образуются в печени из глутаминовой кислоты. Источником всех атомов углерода (а также азота аминогрупп) пролина, орнитина и аргинина является глутамат.
Источником углерода аланина, серина и глицина служат трехуглеродные промежуточные продукты гликолиза, а источником азота их аминогрупп – глутамат; аспартат получает углерод от оксалоацетата, а азот от глутамата.
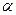

Глутамат + 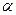

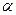
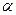

Восстаниовительное аминирование в печени и других тканях обеспечивает сохраниение и повторное использование аммиака. Большая часть аминокислот синтезируется в результате переноса аминогрупп от других аминокислот без превращения в NH3.
Трансаминирование = переаминирование = аминирование 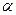
Трансаминированию в печени не подвергаются аминокислоты с разветвленной цепью – лейцин, изолейцин, валин.
Эти аминокислоты вступают в реакции трансаминироания в почечной и мышечной тканях.
Лизин и треонин не вступают в реакцию трансаминирования.
Токсическое действие аммиака-инактивация альфа-кетоглутарата в цикле кребса,энергетическое голодание,к которому чувствителна очень нервная ткань.
Уровень аммиака в норме в крови не превышает 60 мкМоль/литр. Для кроликов концентрация аммиака 3 мМоль/литр является летальной.
В тканях организма происходит отщепление аминогрупп с образованием аммиака. Этот процесс называется дезаминированием. Возможны 4 типа дезаминирования:
R-CH-COOH 
R-CH-COOH 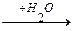
R-CH2-CH-COOH 
R-CH-COOH 
Окислительное дезаминирование бывает 2 видов: прямое и непрямое (трансдезаминирование).
Прямое окислительное дезаминирование осуществляется оксидазами. В качестве кофермента содержат ФМН или ФАД. Продуктами реакции являются кетокислоты и аммиак.
Трансдезаминирование – основной путь дезаминирования аминокислот. Трансдезаминирование проходит в 2 этапа.
Первый – трансаминирование – перенос аминогруппы с любой аминокислоты на 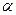
Второй – собственно окислительное дезаминирование.
В результате первого этапа аминогруппы «собираются» в составе глутаминовой кислоты. Второй этап связан с окислительным дезаминированием глутаминовой кислоты.
Трансаминирование аминокислот было открыто советскими учеными Браунштейном и Крицман (1937г).
HC-NH2 + C=O 
Реакция трансаминирования обратима, она катализируется ферментами – аминотрансферазами.
Акцептором аминогрупп в реакциях трансаминирования являются три 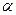
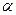
НСNH2 + CH2 
Аминотрансферазы содержат в качестве кофермента производные пиридоксина (витамин В6) – пиридоксаль-фосфат и пиридоксамин-фосфат.
(Механизм реакции трансаминирования с участием пиридоксальфосфата – учебник.)
2. Окислительное дезаминирование глутаминовой кислоты.
Биологический смысл реакций трансаминирования состоит в том, чтобы собрать аминогрупы всех распадающихся аминокислот в составе одной аминокислоты – глутаминовой. Глутаминовая кислота поступает в митохондрии клеток, где происходит второй этап трансдезаминирования – собственно дезаминирование глутаминовой кислоты. Реакция катализируется глутаматдегидрогеназой, которая в качестве кофермента содержит НАД + или НАДФ + .


Клиническое значение определения активности трансаминаз.
Для клинических целей определяют активность АлТ и АсТ, которые катализируют следующие реакции:
Аспартат + 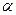

Аланин + 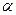

В сыворотке крови здоровых людей активность этих трансаминаз ниже, чем в органах. При поражении органов наблюдается выход трансаминаз из очага поражения в кровь. Так, при инфаркте миокарда уровень АсТ сыворотки крови уже через 3-5 ч после наступления инфаркта повышается в 20-30 раз. При гепатитах повышается более умеренное и затяжное.
В организме биогенные амины подвергаются реакции окислительного дезаминирования с образованием альдегидов и аммиака. Процесс осуществляется при участии моноаминооксидаз.
Схематически механизм трансдезаминирования можно представит так:
Трансдезаминирование – основной путь дезаминирования аминокислот. Трансдезаминирование проходит в 2 этапа.
Первый – трансаминирование – перенос аминогруппы с любой аминокислоты на 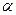
Второй – собственно окислительное дезаминирование.
В результате первого этапа аминогруппы «собираются» в составе глутаминовой кислоты. Второй этап связан с окислительным дезаминированием глутаминовой кислоты.
Трансаминирование аминокислот было открыто советскими учеными Браунштейном и Крицман (1937г).
HC-NH2 + C=O 
Реакция трансаминирования обратима, она катализируется ферментами – аминотрансферазами.
Акцептором аминогрупп в реакциях трансаминирования являются три 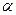
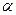
НСNH2 + CH2 
Аминотрансферазы содержат в качестве кофермента производные пиридоксина (витамин В6) – пиридоксаль-фосфат и пиридоксамин-фосфат.
(Механизм реакции трансаминирования с участием пиридоксальфосфата – учебник.)
4. Окислительное дезаминирование глутаминовой кислоты.
Биологический смысл реакций трансаминирования состоит в том, чтобы собрать аминогрупы всех распадающихся аминокислот в составе одной аминокислоты – глутаминовой. Глутаминовая кислота поступает в митохондрии клеток, где происходит второй этап трансдезаминирования – собственно дезаминирование глутаминовой кислоты. Реакция катализируется глутаматдегидрогеназой, которая в качестве кофермента содержит НАД + или НАДФ + .


Клиническое значение определения активности трансаминаз.
Для клинических целей определяют активность АлТ и АсТ, которые катализируют следующие реакции:
Аспартат + 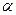

Аланин + 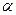

В сыворотке крови здоровых людей активность этих трансаминаз ниже, чем в органах. При поражении органов наблюдается выход трансаминаз из очага поражения в кровь. Так, при инфаркте миокарда уровень АсТ сыворотки крови уже через 3-5 ч после наступления инфаркта повышается в 20-30 раз. При гепатитах повышается более умеренное и затяжное.
источник







