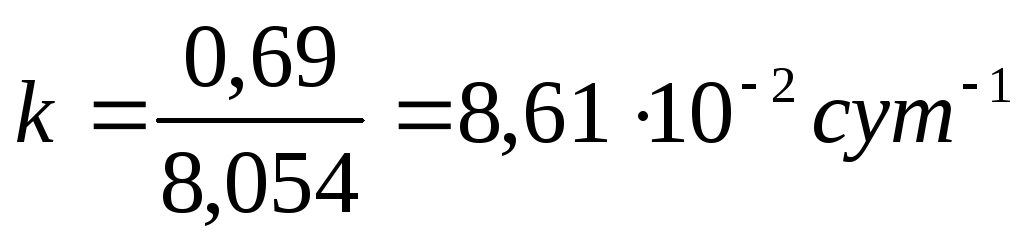1. Константа скорости распада пенициллина при 36°С равна 6 ∙ 10 –6 c –1 а при 41 о С – 1,2 ∙ 10 –5 с –1 . Вычислите температурный коэффициент реакции.
Решение: по правилу Вант-Гоффа 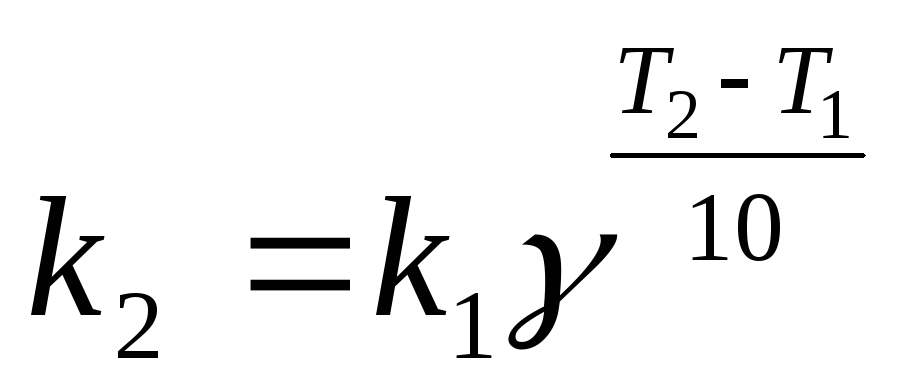
Ответ: температурный коэффициент реакции равен 4.
2. Во сколько раз увеличится скорость реакции СО + 3 Н2 → СН4 + Н2О при увеличении давления в 3 раза:
Решение. Согласно закону действующих масс,
При увеличении давления в 3 раза увеличивается концентрация газообразных веществ в 3 раза, следовательно:
V2 = 3 . 27 . k . C (CO) . С 3 (
Ответ: скорость реакции увеличится в 81 раз.
3. Период полураспада радиоактивного изотопа 32 Si равен 6 ч. Рассчитайте время, по истечении которого останется нераспавшимся 20 % исходного вещества.
Решение. Константа скорости реакции распада кремния, исходя из того, что данная реакция является реакцией первого порядка, рассчитывается по формуле: 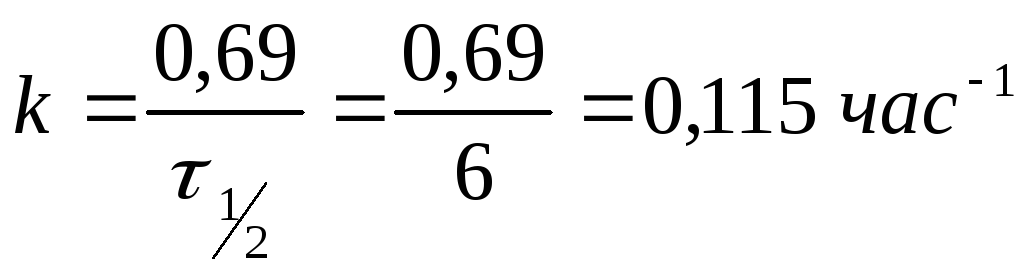

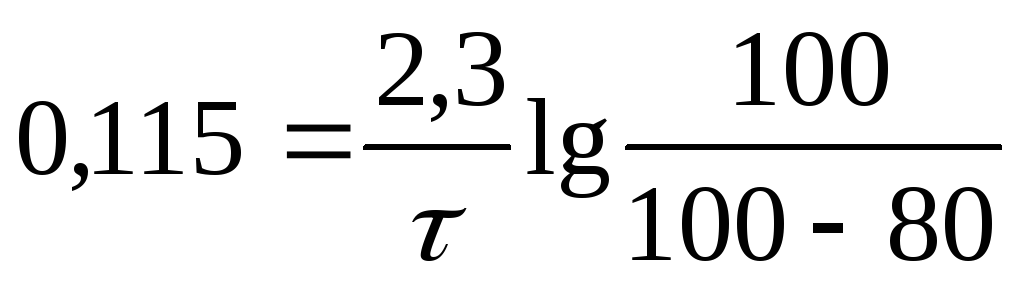

Ответ: через 14 ч останется 20 % исходного изотопа 32 Si.
4. При авариях на АЭС появляется радиоактивный изотоп йода 131 I. За какое время этот изотоп распадается на 99%? (
Решение: Константа скорости радиоактивного распада, протекающей по первому порядку, определяется по формуле:

Концентрация исходного вещества (С) 100%, следовательно:

Ответ: изотоп 131 I распадается на 99% через 53,5 сут.
5. Во сколько раз увеличится скорость реакции, протекающей при 298 К, если энергию активации (Eа) уменьшить на 4 кДж/моль?
Решение: Из уравнения Аррениуса следует
Ответ: скорость реакции увеличится в 5 раз
6. Константы скорости реакции перегруппировки метилизонитрила при различных температурах следующие k1= 2,52 . 10 -5 t 0 1 = 189 0 C
k2 = 3,168 . 10 -3 t 0 2 = 251 0 C
Вычислите энергию активации данной реакции.
Из уравнения Аррениуса следует:
Ответ: энергия активации равна 156,533 кДж/моль
7. Вычислите константу равновесия реакции 2NO + O2 ↔ 2NO2 и исходные концентрации веществ NO и O2, если равновесные концентрации равны
С(NO) = 0,06 моль/л, С(О2) = 0,14 моль/л, С(NO2) = 0,206 моль/л
Константа равновесия выражается уравнением:
Исходные концентрации веществ, исходя из того, что из двух молей NO и одного моля О2 образуется два моля NO2 , равны:
C(NO) = 0,206 моль + 0,06 моль = 0,266 моль
С(O2) = 0,206 : 2 моль + 0,14 моль = 0,552 моль
Ответ: 0,206 моль; 0,552 моль
Задача 1. Как изменится скорость прямой реакции
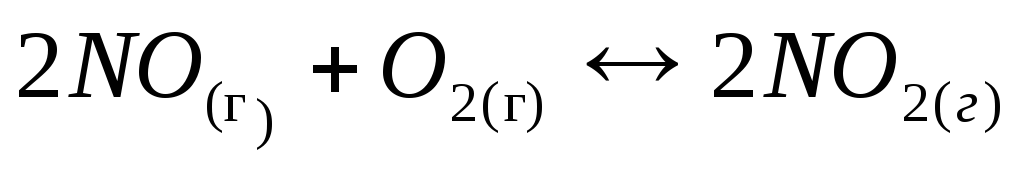
Задача 2. Рассчитайте константу равновесия для обратимой реакции 


Задача 3. Для реакции

Ответ: Кс = 3,48
Задача 4. Вычислите энергию активации реакции спиртового брожения глюкозы в растворе в интервале 30÷70 0 С при температурном коэффициенте, равном 2,0. Ответ: 57,3 кДж.
Задача 5. Во сколько раз возрастет скорость реакции при повышении температуры от 25 до 85 0 С, если энергия активации равна 100 кДж/моль? Рассчитайте температурный коэффициент этой реакции.
Ответ: в 876 раз; 
Задача 6. Период полураспада радиактивного изотопа 32 Р равен 14,3 дня. Вычислите скорость данного процесса.
Задача 7. Рассчитайте, во сколько раз возрастет скорость реакции разложения угольной кислоты при 310К при использовании катализатора (без катализатора Е

Ответ: в 1,73
Задача 8. В печени протекает ферментативный обратимый процесс: глюкозо-1-фосфат
Задача 9. Энергия активации реакции кислотного гидролиза сахарозы при 37 0 С равна 102 кДж/моль, а в присутствии фермента энергия активации снижается до 35 кДж/моль. Во сколько раз быстрее протекает реакция гидролиза сахарозы в присутствии фермента?
Ответ: в присутствии фермента скорость реакции гидролиза сахарозы возросла в 1,97
Задача 10. Рассчитайте, за какое время в организме останется 10% введённого в кровяное русло изотопа 51 Cr , если период полураспада изотопа равен 22,7 сут.
источник
Пример 2: Во сколько раз увеличится скорость реакции при повышении температуры на 30 о С, если температурный коэффициент скорости реакции равен 2?
Решение: По уравнениию Вант-Гоффа: v t
Скорость реакции возрастает в 8 раз.
Пример 3: Начальные концентрации веществ в системе:
СО (г) + Н 2 О (г) 
были равны (моль/л): С 0 (СО) = 0,5; С 0 (Н 2 О) = 0,6; С 0 (СО 2 ) = 0,4; С 0 (Н 2 ) = 0,2. Чему равны концентрации всех участвующих в реак-
ции веществ после того, как прореагирует 30% водяных паров? Решение: 1. Рассчитаем, какое количество воды прореагировало:
n(H 2 O) = 0,6 ∙ 0,3 = 0,18 (моль) 2. Концентрация воды после реакции:
C 1 (H 2 O) = 0,6 – 0,18 = 0,42 (моль/л)
3. Согласно уравнению, 1 моль СО реагирует с 1 моль Н 2 О, при этом образуется 1 моль СО 2 и 1 моль Н 2 . Значит, концентрация СО уменьшится на 0,18 моль и станет равна:
C 1 (CO) = 0,5 – 0,18 = 0,32 (моль/л)
C 1 (CO 2 ) = 0,4 + 0,18 = 0,58 (моль/л).
C 1 (H 2 ) = 0,2 + 0,18 = 0,38 (моль/л).
Пример 4: Рассчитайте константу равновесия реакции:
СО + Н 2 О 
равновесия равны (моль/л): C(H 2 O) = 0,42; C(CO 2 ) = 0,58; C(СО) = 0,32; C(H 2 ) = 0,38.
Во сколько раз увеличится скорость реакции, протекающей при
298 К, если энергию активации (Е А ) уменьшить на 4 кДж/моль?
(уравнение Аррениуса), где k 1 и k 2 – константы ско-
и Е А2 соответственно, ∆Е = Е А2 – Е А1 .
= 5,03, т.е. скорость реакции увеличится в 5 раз.
1. Вычислите среднюю скорость реакции, если начальная концентрация исходного вещества была равна 10 моль/л, а через 4 минуты стала 2 моль/л.
2. Как изменится скорость прямой реакции 2 СО (г) + О 2(г) 
3. Напишите выражение зависимости скорости прямой реакции от концентрации реагирующих веществ:
в) 2 SО 2 (г) + О 2 (г) 2 SО 3 (г) ;
Укажите порядок каждой реакции.
4. Как изменится скорость реакции, если температура повысится с 30 о С до 60 о С, а температурный коэффициент реакции равен 3?
5. Обратима ли практически реакция гидролиза дипептида глицил-глицина при 310 К, если ∆G р-ции = -15 кДж/моль?
6. Во сколько раз уменьшится скорость окисления глюкозы при гипотермии, если температура падает с 38 о С до 28 о С, а температурный коэффициент реакции равен 2?
7. Реакция идет согласно уравнению: Н 2 (г) + Сl 2 (г) → 2 HCl (г) . Концентрация исходных веществ до начала реакции: [Н 2 ] = 0,06 моль/л; [Cl 2 ] = 0,08 моль/л. Как изменится скорость реакции, по сравнению с первоначальной, когда прореагирует половина водорода?
8. При состоянии равновесия в системе N 2 + 3 H 2 
ствующих веществ равны (моль/л): С N 2 = 3; С Н 2 = 9; С NН 3 = 4.
Определите: а) исходные концентрации водорода и азота; б) в каком направлении сместится равновесие, если увеличить в системе давление?
9. Укажите, какими изменениями концентраций реагирующих веществ можно
сместить вправо равновесие реакции: СО 2 (г) + С (т) 
10.В печени протекает ферментативный обратимый процесс: глюкозо-1-фосфат 
При 37 о С равновесная концентрация глюкозо-1-фосфата равна 0,001 моль/л, глюкозо-6-фосфата – 0,019 моль/л. Рассчитайте константу равновесия реакции.
11. Определите, как изменится скорость прямой реакции 2 SO 2 + О 2
если давление в системе увеличить в 4 раза.
12. * Энергия активации реакции кислотного гидролиза сахарозы при 37 о С равна 102 кДж/моль, а при действии фермента сахарозы энергия активации снижается до 35 кДж/моль. Во сколько раз быстрее протекает реакция гидролиза сахарозы в присутствии фермента?
Тема 4: «Растворы. Получение растворов. Способы выражения
1. Истинные растворы. Понятие растворитель, растворенное вещество. Сольваты, гидраты, идеальный раствор.
2. Растворы разбавленные, концентрированные, насыщенные, ненасыщенные, пересыщенные.
3. Способы выражения состава растворов:
массовая доля, объемная доля, мольная доля;
молярная концентрация эквивалента (эквивалентная, или нормальная концентрация);
4. Приготовление растворов разных концентраций. Правило смешения (правило «креста»).
5. Растворимость веществ. Растворимость газов в жидкости. Закон Генри. Закон Сеченова. Растворимость газов в крови и тканевых жидкостях.
7. Роль водных растворов в биологических системах.
Пример 1: Рассчитайте массовую долю вещества в растворе, если 15,0 г вещества растворено в 60 г воды.
Решение: Массовая доля вещества в растворе рассчитывается по формуле:
Пример 2: Сколько необходимо граммов кристаллогидрата карбоната натрия Na 2 CO 3 ∙ 10 H 2 O, чтобы приготовить 300 г 2 %-го раствора (в расчете на безводную соль)? Как приготовить такой раствор?
Решение: 1) Сколько необходимо граммов безводной соли для приготовления
2) Сколько необходимо взять граммов кристаллогидрата, чтобы безводной соли в нем содержалось 6 г:
23 ∙ 2 +12 + 48 + 10 ∙ 18 = 106 +180 = 286 г/моль
3) Сколько необходимо растворителя для приготовления раствора:
4) Приготовление раствора: отвесить 16,1 г соли, перенести в химическую посуду (стакан, колбу) и добавить 284 мл дистиллированной воды. Перемешать до растворения навески.
Пример 3: Как приготовить 200 мл 0,2 М раствора гидроксида натрия? Решение: 1) Рассчитаем навеску NaOH, необходимого для приготовления рас-
m в-ва = С М ∙ V р-ра ∙ М NaOH = 0,2 ∙ 0,2 ∙ 40 = 0,16 г
Приготовление раствора: отвесить 0,16 г NaOH, перенести в мерную колбу на 200 мл, добавить немного воды, растворить навеску и долить дистиллированную воду до метки на колбе.
Пример 4: Как приготовить 250 мл 0,1 н раствора фосфорной кислоты? Решение: 1) Рассчитаем навеску H 3 PO 4 , необходимую для приготовления рас-
m(H 3 PO 4 ) = 0,1 ∙ 0,25 ∙ 32,6 = 0,81 г
2) Приготовление раствора аналогично приготовлению раствора молярной концентрации (см. пример 3).
Пример 5: Рассчитайте, какой необходимо взять объем 90% серной кислоты с плотностью 1,82 г/см 3 , чтобы приготовить 500 мл 0,2 н раствора.
Решение: 1) Сколько серной кислоты содержится в 500 мл 0,2 н раствора? m(H 2 SO 4 ) = С Н ∙ М Э ∙ V = 0,2 ∙ 0,5 ∙ 49 = 4,9 г
2) Сколько граммов 90% раствора необходимо взять, чтобы в нем содержалось 4,9 г кислоты?
х « « — 4,9 г х = 5,4 г 90 % раствора
3) Какой необходимо взять объем 90% раствора?
m – масса раствора; V – объем раствора; ρ – плотность.
1. Для смазывания десен приготовлен раствор из 5 мл 30%-го раствора Н 2 О 2 и
15 мл дистиллированной воды. Рассчитайте массовую долю Н 2 О 2 в полученном растворе (плотность раствора принять равной 1 г/мл).
2. К 0,5 л 98%-го раствора серной кислоты (ρ = 1,83 г/см 3 ) прибавлено 3 л воды. Какова массовая доля серной кислоты в полученном растворе?
3. Сколько мл 94%-го раствора серной кислоты (ρ = 1,84 г/см 3 ) требуется для приготовления 1 л 20%-го раствора (ρ = 1,14 г/см 3 )?
4. Сколько мл 34%-ной серной кислоты (ρ = 1,84 г/см 3 ) необходимо для приготовления 500 мл 0,5 М раствора?
5. Сколько граммов натрия сульфата необходимо для приготовления 250 мл 0,1 н раствора? Как приготовить такой раствор?
6. Найти массовую долю азотной кислоты в растворе, в 1 л которого (ρ = 1,1 г/см 3 ) содержится 200 г азотной кислоты.
7. Хлорид цинка используется в качестве вяжущего и асептического средства. Определите молярную концентрацию, молярную концентрацию эквивалента, массовую долю и титр раствора, содержащего 5 г ZnCl 2 в 100 г раствора (ρ =
8. Определите молярную концентрацию раствора, содержащего в 500 мл раствора 14 г гидроксида калия.
9. В каком массовом и объемном соотношении надо смешать 40%-ный (ρ = 1,3 г/см 3 ) и 10%-ный (ρ = 1,1 г/см 3 ) растворы, чтобы получить 30%-ный раствор?
10.Чему равен титр раствора, содержащего в 100 мл 2 г растворенного вещества?
11.Рассчитайте молярную, моляльную и эквивалентную концентрации 75% раствора серной кислоты (ρ = 1,65 г/см 3 ) и мольные доли компонентов в этом растворе.
12.1 л 10%-го раствора КОН (ρ = 1,09 г/см 3 ) смешали с 0,5 л 10%-го раствора HCl (ρ = 1,05 г/см 3 ). Рассчитайте массовые доли (в %) веществ, содержащихся в полученном растворе.
13. * Сколько мл 10%-го раствора серной кислоты (ρ = 1,066 г/см 3 ) необходимо прибавить к 2 л 92%-го раствора этой же кислоты (ρ = 1,824 г/см 3 ), чтобы получить 75%-ный раствор?
14. * Какой объем 0,25 н H 2 SO 4 можно нейтрализовать прибавлением 0,6 л 0,15 н Са(ОН) 2 ?
15. * Смешаны 0,8 л 1,5 н NaOH и 0,4 л 0,6 н NaOH. Какова молярная концентрация эквивалента полученного раствора?
Тема 5: «Растворы неэлектролитов.
Коллигативные свойства растворов»
1. Понятие о неэлектролитах.
2. Свойства разбавленных растворов неэлектролитов, законы Рауля: а) понижение давления пара над раствором;
б) повышение температуры кипения раствора, эбулиоскопическая константа; в) понижение температуры замерзания раствора, криоскопическая константа; г) осмос, осмотическое давление. Закон Вант-Гоффа.
3. Определение молекулярной массы растворенного вещества по коллигативным свойствам раствора.
4. Роль осмотического давления в биологических системах. Онкотическое давление.
Пример 1 : Рассчитайте температуру замерзания раствора, содержащего в 125 г
воды 27 г глюкозы С 6 Н 12 О 6 .
Решение : Понижение температуры замерзания раствора по сравнению с чистым растворителем можно найти по формуле:
где: С m – моляльная концентрация.
М(С 6 Н 12 О 6 ) = 180 г/моль
Следовательно, раствор замерзнет при температуре -2,23 о С.
При растворении 26,0 г неэлектролита в 400 г воды температура ки-
пения повысилась на 0,45 о С. Определите молярную массу раство-
t кип.. = Е ∙ С m выразим молярную массу:
Пример 3: Вычислите осмотическое давление 0,5 М раствора глюкозы при стандартной температуре.
Решение: Осмотическое давление находим по формуле: Р осм. = С М ∙ R ∙ T, где:
С М – молярная концентрация; R = 8,31 Дж/моль∙К (универсальная га-
зовая постоянная); Т = 273 + 25 о С = 298 К; Р осм. = 0,5 ∙ 8,31 ∙ 298 =
1. Рассчитайте, при какой температуре замерзнет раствор, содержащий в 100 г воды 9 г глюкозы.
2. В радиатор автомобиля налили 9 л воды и прибавили 2 л метилового спирта (ρ = 0,8 г/см 3 ). При какой наинизшей температуре можно после этого оставлять автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет?
3. Рассчитайте осмотическое давление при 310 К 20%-ного водного раствора глюкозы (ρ = 1,08 г/мл), применяемого для внутривенного введения. Каким будет этот раствор (гипо-, гипер-, изотоническим) по отношению к крови, если учесть, что Р осм. крови составляет 740-780 кПа?
4. Что произойдет с эритроцитами при 310 К в 2%-ном растворе глюкозы
5. Осмотическое давление крови 760 кПа. Какова молярная концентрация глюкозы в растворе, изотоничном крови при 37 о С?
6. Добавление 1,5 г углевода, извлеченного из овсяных отрубей, к 5 г воды понижает ее температуру замерзания до -3,72 о С. Чему равна молярная масса этого углевода?
7. Определите, сколько атомов входит в молекулу серы, если температура кипения раствора, содержащего 4,4 г серы в 50 г бензола на 0,891 о С выше температуры кипения чистого бензола (Е С 6 Н 6 = 2,6 о С).
8. Определите знак и значение энтальпии растворения соли NH 4 NO 3 , если при
растворении 6,4 г этой соли при стандартных условиях поглотилось 6,22 кДж теплоты. Растворителя добавлено столько, что дальнейшее прибавление его не вызывает тепловых эффектов.
9. Рассчитайте молярную массу неэлектролита, если 28,5 г этого вещества, рас-
творенного в 785 г воды, вызывают понижение давления пара воды над раствором на 52,37 Па при 25 о С. Давление пара над чистым растворителем равно
10. * Раствор, содержащий в 300 г растворителя 8,1 г кристаллического органического вещества, имеет температуру кипения на 0,078 о С выше, чем чистый растворитель. Прибавление 2 моль растворенного вещества на 200 г растворителя поднимает температуру кипения этого раствора на 5,2 о С. Определите молярную массу вещества.
11. * Водный раствор, содержащий нелетучее растворенное вещество (неэлектролит) замерзает при -3,5 о С. Определите температуру кипения раствора и давление пара над раствором при 25 о С. Давление пара над чистой водой при 25 о С равно 167,2 Па.
Тема 6: «Свойства растворов электролитов»
1. Какие вещества называют электролитами?
2. Отклонение свойств растворов электролитов от законов Вант-Гоффа и Рауля. Изотонический коэффициент.
3. Основы теории электролитической диссоциации. Диссоциация кислот, солей и оснований в растворе. Амфотерные электролиты. Гидратация ионов.
4. Степень диссоциации. Факторы, определяющие степень диссоциации: природа растворенного вещества и растворителя, концентрация раствора, температура. Связь степени диссоциации с изотоническим коэффициентом.
5. Сильные электролиты. Истинная и кажущаяся степени диссоциации в растворах сильных электролитов. Активность электролита. Коэффициент активности. Ионная сила раствора.
6. Слабые электролиты. Равновесие в растворах слабых электролитов. Константа диссоциации. Связь константы со степенью диссоциации (закон разбавления Оствальда). Смещение равновесия в растворах слабых электролитов.
7. Диссоциация многоосновных кислот, многокислотных оснований.
8. Обменные реакции в растворах электролитов. Ионные уравнения реакций.
9. Произведение растворимости малорастворимых электролитов.
Пример 1: Вычислите степень диссоциации гидроксида аммония в 0,01 М растворе. Константа диссоциации гидроксида аммония равна 1,8 · 10 -5 .
Решение: Для расчета степени диссоциации используем формулу:
Пример 2: 0,5 моляльный раствор сахара и 0,2 моляльный раствор хлорида кальция замерзают при одинаковой температуре. Определите степень диссоциации хлорида кальция.
Решение: 1. Для раствора сахара t зам. = К ∙ С 1 , где С 1 – моляльная концентрация раствора сахара. Для раствора хлорида кальция t зам. = i K ∙ C 2 ,
где С 2 – моляльная концентрация раствора хлорида кальция. Т.к. температура замерзания обоих растворов одинакова, то:
2. Степень диссоциации можно рассчитать с помощью изотонического коэффициента:
где n – число ионов, на которое диссоциирует хлорид кальция: CaCl 2 → Ca 2+ + 2Cl ˉ, n = 3.
Пример 3: Рассчитайте ионную силу раствора, содержащего в 100 мл 0,003 моль хлорида натрия и 0,002 моль хлорида кальция. Определите активность хлорид-ионов в растворе.
Решение: Ионную силу раствора найдем по формуле:
где С i молярные концентрации ионов, Z i – заряды ионов. Определим молярную концентрацию NaCl и CaCl 2 :
C(Na + ) = 0,03 моль/л; C(Ca 2+ ) = 0,02 моль/л;
C(Clˉ) = 0,03 + 0,02 ∙ 2 = 0,07 моль/л
μ = 1 2 [0,03 ∙ (+1) 2 + 0,02 ∙ (+2) 2 + 0,07 ∙ (-1) 2 ] = 1 2 ∙ 0,18 = 0,09 lg f = -0,5 z 2
lg f(Clˉ) = -0,5 ∙ (-1) 2 ∙ 
а = f ∙ C = 0,71 ∙ 0,07 = 0,0497 0,05 моль/л
Пример 4: Нижний предел бактерицидного действия серебра оценивается концентрацией его в растворе 10 -6 мг/л. Достаточно ли серебра в насыщенном растворе AgCl для его бактерицидного действия? ПР AgCl =
1,8 10 10 = 1,34 ∙ 10‾ 5 моль/л =
= 1,34 ∙ 10‾ 5 моль/л ∙ 108 г/моль = 1,45 ∙ 10‾ 3 г/л = 1,45 ∙ 10‾ 6 мг/л
насыщенный раствор AgCl обладает бактери-
1. Составьте уравнения диссоциации следующих электролитов: сероводородной кислоты, хлорида алюминия, гидрокарбоната калия, дигидрофосфата натрия, гидроксохлорида меди (II), гидроксида железа (III), сернистой кислоты.
2. Рассчитайте осмотическое давление изотонического раствора хлорида на-
трия (ω (NaCl) = 0,9%), который используется для внутривенного введения, считая диссоциацию хлорида натрия полной (t =37 о С, ρ р-ра = 1 г/см 3 .).
3. Осмотическое давление 0,1 М раствора сульфата натрия при 0 о С равно 459 кПа. Определите кажущуюся степень диссоциации соли в данном растворе.
4. Раствор, содержащий 0,53 г карбоната натрия в 200 г воды, кристаллизуется при температуре -0,13 о С. Рассчитайте кажущуюся степень диссоциации соли.
5. Степень диссоциации угольной кислоты по первой ступени в 0,1 н растворе равна 2,11 · 10 -3 . Вычислите К 1 .
6. Рассчитайте ионную силу раствора «Трисоль», используемого в ветеринарной практике в качестве плазмозаменяющего раствора, если его состав: натрия хлорид – 0,5 г; калия хлорид – 0,1 г; натрия гидрокарбонат – 0,4 г; вода для инъекций – до 100 мл.
7. При отравлении цианидами внутривенно вводят 2% раствор нитрата натрия (ρ = 1,011 г/мл). Вычислите коэффициенты активности ионов в этом растворе.
8. Вычислите ионную силу раствора и активности ионов в растворе, содержащем 0,01 моль/л BaCl 2 и 0,01 моль/л NaCl.
9. К 100 мл 0,002 М раствора нитрата свинца прилили 100 мл 0,002 М раствора хлорида натрия. Выпадет ли в осадок хлорид свинца? ПР PbCl2 = 2,4 · 10 -4 .
11. * Определите константу диссоциации слабой одноосновной кислоты, содержащей в 1 литре 0,01 М раствора 6,26 · 10 21 молекул и ионов.
12. * Раствор, содержащий 0,8718 моль/л тростникового сахара при Т = 291К, изоосмотичен (изотоничен) с раствором хлорида натрия, содержащего 0,5 моль/л хлорида натрия. Определите кажущуюся степень диссоциации хлорида натрия и осмотическое давление растворов.
Тема 7: «Ионное произведение воды. Водородный показатель»
1. Диссоциация воды. Константа диссоциации. Ионное произведение воды. Влияние температуры на диссоциацию воды.
источник
1. В печени протекает ферментативный обратимый процесс:
При 37 о С равновесные концентрации [ Г-1-ф ] = 0,001 моль/л, а [Г-6-ф ] = 0,019 моль/л . Рассчитайте константу равновесия Кс.
2. При некоторой температуре равновесие в системе 2NO2 ↔ 2NO + O2 установилось при следующих концентрациях: [NO]=0,024 моль/л, [NO2] =0,006 моль/л. Найдите К равновесия и исходную концентрацию NO2.
3. Для реакции: Н3РО4 + аденозин ↔ АМФ + Н2О ∆G о = 14 кДж/моль. В каком направлении реакция идет самопроизвольно при стандартных условиях? Каково значение константы равновесия?
4. Рассчитайте константу равновесия реакции гидролиза глицилглицина при 310 К, если ∆G о = — 15,08 кДж/моль. Обратима ли практически эта реакция?
(Ответ: 349; равновесие заметно смещено вправо).
5. Сделайте заключение о практической обратимости реакции в стандартных условиях, рассчитав константу равновесия при 310 К для реакции: АМФ + АТФ ↔ 2 АДФ, ∆G 0 = — 2,10 кДж/моль.
6. Константа равновесия реакции гидратации сывороточного альбумина при 25 0 С равна 1,19. Вычислите значение стандартной энтропии процесса, если известно, что ∆Н 0 = — 6,08 кДж/моль.
7. Для реакции 2N2O ↔ N2O4 константа равновесия при 298К равна 216. Рассчитайте константу равновесия при 46 0 С. Стандартная энтальпия реакции равна – 57,4 кДж/моль. Зависимостью ∆Н 0 и Т пренебречь.
8. Для реакции синтеза аммиака из простых веществ равновесные концентрации при некоторой температуре равны: аммиака 4 моль/л, азота 3 моль/л, водорода 9 моль/л. Каким будет направление процесса при концентрации всех реагентов, равных 5 моль/л?
(Ответ: равновесие смещено в сторону исходных веществ).
studopedia.org — Студопедия.Орг — 2014-2019 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.001 с) .
источник
8. В печени протекает ферментативный обратимый процесс:
При 37 о С равновесные концентрации [ Г-1-ф ]= 0,001 моль/л,а
[ Г-6-ф ]= 0,019 моль/л . Рассчитайте константу равновесия Кс.
9. В системе 2NO + O2 ↔ 2NO2 равновесные концентрации веществ :
[NO] =0,2, [O2] =0,3, [NO2] =0,4 моль/л. Рассчитайте К равновесия и
оцените положение равновесия . (Ответ: 13,3, смещено вправо).
10. Для реакции : Н3РО4 + аденозин ↔ АМФ + Н2О ∆G о = 14 кДж/моль.
В каком направлении реакция идет самопроизвольно при стандартных
условиях? Каково значение константы равновесия?
11. Рассчитайте константу равновесия реакции гидролиза глицилглицина при
310 К, если ∆G о = — 15,08 кДж/моль. Обратима ли практически эта
реакция? (Ответ: 355,равновесие заметно смещено вправо).
12. Рассчитайте начальную скорость реакции первого порядка гидролиза
сахарозы при 25 о С. Концентрация сахарозы 3% (0,088 моль/л), константа
скорости k = 0,77 c -1 . (Ответ: 0,068 моль/(л∙с)).
13. Найдите начальную скорость реакции Н2О2 +2НI = I2+ 2Н2О, если
смешали равные объемы 0,02 моль/л раствора Н2О2 и 0,05 моль/л
раствора НI. Константа скорости 0,05 л/(моль∙с), реакция имеет первый
порядок по обоим реагентам. (Ответ: 1,25∙10 -5 моль/(л∙с)).
14. Во сколько раз уменьшается скорость окисления глюкозы при
гипотермии, если температура тела падает с 36,6 до 27 о С, температурный
коэффициент данной реакции равен 1,3? (Ответ: в 12,4 раз)
15. Константа скорости распада пенициллина при 36 о С равна 6 ∙10 -6 с -1 , а при
41 о С 1,2 ∙10 -5 с -1 .Вычислите температурный коэффициент реакции.
16. Реакция заканчивается за 16 мин. при 10 о С,температурный коэффициент
γ =2.За какое время реакция закончится при 50 о С? (Ответ: 1мин.).
17. Во сколько раз возрастет скорость реакции разложения угольной кислоты
при 310 К в присутствии фермента? Без катализатора Еа =86 кДж/моль, в
присутствии карбоангидразы Еа= 49 кДж/моль. (Ответ: 1,73 10 6 раз).
1. Уксусная кислота диссоциирует в водном растворе по уравнению
Рассчитайте константу равновесия этой реакции, если исходная
концентрация уксусной кислоты равна 0,4 моль/л, равновесная
концентрация ацетат-ионов равна 2,6∙10 -3 моль/л.
2. Вычислите энергию Гиббса ( ∆G о ) реакции АТФ + Н2О ↔ АДФ + Ф
В условиях, характерных для мышечной клетки, находящейся в состоянии
покоя: С(АТФ)=0,005моль/л; С(АДФ)=0,0005моль/л; С(Ф)=0,005 моль/л;
рН=6; t =25 о С. Константа равновесия гидролиза при этой температуре
3. При лечении онкологических заболеваний в опухоль вводят препарат,
содержащий радиоактивный иридий-192. Рассчитайте, какая часть
введенного радионуклида останется в опухоли через 10 суток. Период
полураспада его равен 74,08 суток. Реакция первого порядка.
4. Вычислите энергию активации реакции спиртового брожения глюкозы в
растворе в интервале 30-70 о С при γ =2.
5. При хранении таблеток анальгина установлено, что константа скорости
разложения при 20 о С равна 1,5 ∙ 10 -9 с -1 . Определите срок хранения
таблеток (время разложения 10% вещества) при 20 о С.
studopedia.org — Студопедия.Орг — 2014-2019 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.001 с) .
источник
8. В печени протекает ферментативный обратимый процесс:
При 37 о С равновесные концентрации [ Г-1-ф ]= 0,001 моль/л,а
[ Г-6-ф ]= 0,019 моль/л . Рассчитайте константу равновесия Кс.
9. В системе 2NO + O2 ↔ 2NO2 равновесные концентрации веществ :
[NO] =0,2, [O2] =0,3, [NO2] =0,4 моль/л. Рассчитайте К равновесия и
оцените положение равновесия . (Ответ: 13,3, смещено вправо).
10. Для реакции : Н3РО4 + аденозин ↔ АМФ + Н2О ∆G о = 14 кДж/моль.
В каком направлении реакция идет самопроизвольно при стандартных
условиях? Каково значение константы равновесия?
11. Рассчитайте константу равновесия реакции гидролиза глицилглицина при
310 К, если ∆G о = — 15,08 кДж/моль. Обратима ли практически эта
реакция? (Ответ: 355,равновесие заметно смещено вправо).
12. Рассчитайте начальную скорость реакции первого порядка гидролиза
сахарозы при 25 о С. Концентрация сахарозы 3% (0,088 моль/л), константа
скорости k = 0,77 c -1 . (Ответ: 0,068 моль/(л∙с)).
13. Найдите начальную скорость реакции Н2О2 +2НI = I2+ 2Н2О, если
смешали равные объемы 0,02 моль/л раствора Н2О2 и 0,05 моль/л
раствора НI. Константа скорости 0,05 л/(моль∙с), реакция имеет первый
порядок по обоим реагентам. (Ответ: 1,25∙10 -5 моль/(л∙с)).
14. Во сколько раз уменьшается скорость окисления глюкозы при
гипотермии, если температура тела падает с 36,6 до 27 о С, температурный
коэффициент данной реакции равен 1,3? (Ответ: в 12,4 раз)
15. Константа скорости распада пенициллина при 36 о С равна 6 ∙10 -6 с -1 , а при
41 о С 1,2 ∙10 -5 с -1 .Вычислите температурный коэффициент реакции.
16. Реакция заканчивается за 16 мин. при 10 о С,температурный коэффициент
γ =2.За какое время реакция закончится при 50 о С? (Ответ: 1мин.).
17. Во сколько раз возрастет скорость реакции разложения угольной кислоты
при 310 К в присутствии фермента? Без катализатора Еа =86 кДж/моль, в
присутствии карбоангидразы Еа= 49 кДж/моль. (Ответ: 1,73 10 6 раз).
1. Уксусная кислота диссоциирует в водном растворе по уравнению
Рассчитайте константу равновесия этой реакции, если исходная
концентрация уксусной кислоты равна 0,4 моль/л, равновесная
концентрация ацетат-ионов равна 2,6∙10 -3 моль/л.
2. Вычислите энергию Гиббса ( ∆G о ) реакции АТФ + Н2О ↔ АДФ + Ф
В условиях, характерных для мышечной клетки, находящейся в состоянии
покоя: С(АТФ)=0,005моль/л; С(АДФ)=0,0005моль/л; С(Ф)=0,005 моль/л;
рН=6; t =25 о С. Константа равновесия гидролиза при этой температуре
3. При лечении онкологических заболеваний в опухоль вводят препарат,
содержащий радиоактивный иридий-192. Рассчитайте, какая часть
введенного радионуклида останется в опухоли через 10 суток. Период
полураспада его равен 74,08 суток. Реакция первого порядка.
4. Вычислите энергию активации реакции спиртового брожения глюкозы в
растворе в интервале 30-70 о С при γ =2.
5. При хранении таблеток анальгина установлено, что константа скорости
разложения при 20 о С равна 1,5 ∙ 10 -9 с -1 . Определите срок хранения
таблеток (время разложения 10% вещества) при 20 о С.
studopedia.org — Студопедия.Орг — 2014-2019 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.002 с) .
источник
Типовые задачи .
8. В печени протекает ферментативный обратимый процесс:
При 37 о С равновесные концентрации [ Г-1-ф ]= 0,001 моль/л,а
[ Г-6-ф ]= 0,019 моль/л . Рассчитайте константу равновесия Кс.
9. В системе 2NO + O2 ↔ 2NO2 равновесные концентрации веществ :
[NO] =0,2, [O2] =0,3, [NO2] =0,4 моль/л. Рассчитайте К равновесия и
оцените положение равновесия . (Ответ: 13,3, смещено вправо).
10. Для реакции : Н3РО4 + аденозин ↔ АМФ + Н2О ∆G о = 14 кДж/моль.
В каком направлении реакция идет самопроизвольно при стандартных
условиях? Каково значение константы равновесия?
11. Рассчитайте константу равновесия реакции гидролиза глицилглицина при
310 К, если ∆G о = — 15,08 кДж/моль. Обратима ли практически эта
реакция? (Ответ: 355,равновесие заметно смещено вправо).
12. Рассчитайте начальную скорость реакции первого порядка гидролиза
сахарозы при 25 о С. Концентрация сахарозы 3% (0,088 моль/л), константа
скорости k = 0,77 c -1 . (Ответ: 0,068 моль/(л∙с)).
13. Найдите начальную скорость реакции Н2О2 +2НI = I2+ 2Н2О, если
смешали равные объемы 0,02 моль/л раствора Н2О2 и 0,05 моль/л
раствора НI. Константа скорости 0,05 л/(моль∙с), реакция имеет первый
порядок по обоим реагентам. (Ответ: 1,25∙10 -5 моль/(л∙с)).
14. Во сколько раз уменьшается скорость окисления глюкозы при
гипотермии, если температура тела падает с 36,6 до 27 о С, температурный
коэффициент данной реакции равен 1,3? (Ответ: в 12,4 раз)
15. Константа скорости распада пенициллина при 36 о С равна 6 ∙10 -6 с -1 , а при
41 о С 1,2 ∙10 -5 с -1 .Вычислите температурный коэффициент реакции.
16. Реакция заканчивается за 16 мин. при 10 о С,температурный коэффициент
γ =2.За какое время реакция закончится при 50 о С? (Ответ: 1мин.).
17. Во сколько раз возрастет скорость реакции разложения угольной кислоты
при 310 К в присутствии фермента? Без катализатора Еа =86 кДж/моль, в
присутствии карбоангидразы Еа= 49 кДж/моль. (Ответ: 1,73 10 6 раз).
1. Уксусная кислота диссоциирует в водном растворе по уравнению
Рассчитайте константу равновесия этой реакции, если исходная
концентрация уксусной кислоты равна 0,4 моль/л, равновесная
концентрация ацетат-ионов равна 2,6∙10 -3 моль/л.
2. Вычислите энергию Гиббса ( ∆G о ) реакции АТФ + Н2О ↔ АДФ + Ф
В условиях, характерных для мышечной клетки, находящейся в состоянии
покоя: С(АТФ)=0,005моль/л; С(АДФ)=0,0005моль/л; С(Ф)=0,005 моль/л;
рН=6; t =25 о С. Константа равновесия гидролиза при этой температуре
3. При лечении онкологических заболеваний в опухоль вводят препарат,
содержащий радиоактивный иридий-192. Рассчитайте, какая часть
введенного радионуклида останется в опухоли через 10 суток. Период
полураспада его равен 74,08 суток. Реакция первого порядка.
4. Вычислите энергию активации реакции спиртового брожения глюкозы в
растворе в интервале 30-70 о С при γ =2.
5. При хранении таблеток анальгина установлено, что константа скорости
разложения при 20 о С равна 1,5 ∙ 10 -9 с -1 . Определите срок хранения
таблеток (время разложения 10% вещества) при 20 о С.
Задание на дом. Реакции комплексообразования.
Место проведения самоподготовки: читальный зал и др.
Литература. [1],[3], [4].
Дата добавления: 2014-10-31 ; Просмотров: 2901 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Реакции, которые протекают в одном направлении и идут до конца, называются необратимыми. Их не так много. Большинство реакций являются обратимыми, т.е. они протекают в противоположных направлениях и не идут до конца. Например, реакция J2 + H2 D 2HJ при 350°С является типичной обратимой реакцией. В этом случае устанавливается подвижное химическое равновесие и скорости прямого процесса и обратного делаются равными.
Химическое равновесие – такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
Химическое равновесие называют динамическим равновесием. При равновесии протекают и прямая, и обратная реакции, их скорости одинаковы, вследствие чего изменений в системе не заметно.
Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными концентрациями. Обычно их обозначают при помощи квадратных скобок, например, [J2], [H2], [HJ].
Количественной характеристикой химического равновесия служит величина, называемая константной химического равновесия. Для реакции в общем виде: mA + nB = pC + qD
Константа химического равновесия имеет вид:
Она зависит от температуры и природы реагирующих веществ, но не зависит от их концентрации. Константа равновесия показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции, если концентрации каждого из реагирующих веществ равна 1 моль/л. В этом физический смысл К.
Направление смещения химического равновесия при изменениях концентрации реагирующих веществ, температуры и давления (в случае газовых реакций) определяется общим положением, известным под названием принципа подвижного равновесия или принципа Ле Шателье: если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменяется концентрация, температура, давление), то оно благоприятствует протеканию одной из двух противоположных реакций, которая ослабляет воздействие.
Следует отметить, что все катализаторы одинаково ускоряют как прямую, так и обратную реакции и поэтому на смещение равновесия влияние не оказывают, а только способствуют более быстрому его достижению.
Примеры решения задач
Рассчитайте температурный коэффициент скорости реакции, зная, что с повышением температуры на 70 °С скорость возрастает в 128 раз.
Для расчета используем правило Вант-Гоффа:
При какой температуре закончится некоторая реакция за 0,5 мин, если при 70°С она заканчивается за 40 мин? Температурный коэффициент реакции равен 2,3.
Для расчета используем правило Вант-Гоффа.Находим t2:
Во сколько раз изменится скорость прямой реакции N2(г)+3Н2(г)=NH3(г), если давление в системе увеличить в 2 раза?
Увеличение давления в системе в 2 раза равносильно уменьшению объема системы в 2 раза. При этом концентрации реагирующих веществ возрастут в 2 раза. Согласно закону действия масс, начальная скорость реакции равна Vн = k·[N2]·[H2] 3 .
После увеличения давления в 2 раза концентрации азота и водорода увеличатся в 2 раза, и скорость реакции станет равна Vк = k·2[N2]·2 3 [H2] 3 = k·32[N2]·[H2] 3 . Отношение Vк/Vн показывает, как изменится скорость реакции после изменения давления. Следовательно, Vк/Vн = k·32[N2]·[H2] 3 /(k·[N2]·[H2] 3 ) = 32.
Ответ: скорость реакции увеличится в 32 раза.
Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению РС15(г) ↔ РС13(г) + С12(г) ; ∆Н = +92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РС15?
Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения РС15 эндотермическая ( 
Задачи для самостоятельного решения
1. Определите, как изменится скорость реакции синтеза аммиака при а) увеличении концентрации исходных веществ в 3 раза; б) при уменьшении давления в реакционной смеси в 2 раза.
2. Как изменится скорость прямой реакции 2СО + О2 ↔ 2СО2 при увеличении концентрации СО в 3 раза?
3. Как изменится скорость прямой реакции 2NO + O2 ↔ 2NO2 при увеличении давления в 2 раза?
4. Определите, как изменится скорость реакции 2SO2 + O2 = 2SO3 при уменьшении концентрации SO2 в два раза и увеличении концентрации О2 в 4 раза.
5. Скорость реакции уменьшается в 6,25 раза при понижении температуры на 20 0 С. Найдите температурный коэффициент реакции.
6. Во сколько раз уменьшится скорость окисления глюкозы при гипотермии, если температура тела падает с 36,6 до 27°С, а температурный коэффициент данной реакции равен 1,3?
7. Константа скорости распада пенициллина при 36 0 С равна 6·10 -6 сек -1 , а при 41 0 С – 1,2·10 -5 сек -1 . Вычислить температурный коэффициент реакции.
8. Химическая реакция при 10 0 С заканчивается за 16 мин. При какой температуре она закончится за 1 мин при температурном коэффициенте реакции равном 2?
9. Температурный коэффициент скорости некоторой реакции равен 2,8. Во сколько раз увеличится скорость реакции при уменьшении температуры от 15 до 35 0 С?
10. Температурный коэффициент скорости некоторой реакции равен 2,5. Как нужно повысить температуру, чтобы скорость реакции возросла в 25 раз?
11. Скорость реакции увеличилась в 5,6 раза при повышении температуры реакционной смеси на 20К. Как изменится скорость реакции при понижении температуры от 57 до 17 0 С?
12. Некоторая реакция характеризуется следующими параметрами уравнения Аррениуса: А = 1,5·10 11 л/(моль·с), Еа = 86,2 кДж/моль, Т = 298К. Рассчитать константу скорости реакции.
13. Для реакции синтеза иодоводорода из простых веществ энергия активации равна 166 кДж/моль, а предэкспоненциальный множитель в уравнении Аррениуса 1,6·10 14 мл/(моль·час) при 350 К. Вычислите константу скорости реакции.
14. В системе 2NO + O2 ↔ 2NO2 равновесные концентрации веществ составляют [NO] = 0,2 моль/л, [O2] = 0,3 моль/л, [NO2] = 0,4 моль/л. Рассчитать Кравн и оценить положение равновесия.
15. Рассчитать величину константы равновесия для обратимой реакции 2NO + O2 ↔ 2NO2, если при состоянии равновесия [NO] = 0,056 моль/л, [O2] = 0,02 моль/л, [NO2] = 0,044 моль/л.
16. Обратима ли практически реакция гидролиза глицил-глицина при 310 К, если ∆G 0 р-ции = -15,08 кДж/моль?
17. При 300 К константа равновесия реакции:
L-глутаминовая кислота + пируват ↔ α-кетоглутаровая кислота + L-аланин равна 1,11. В каком направлении будет идти реакция при следующих концентрациях: L-глутаминовая кислота и пируват по 0,00003 моль/л, α-кетоглутаровая кислота и L-аланин по 0,005 моль/л?
18. Для реакции H3PO4 + аденозин ↔ АМФ + Н2О; ∆G 0 = 14 кДж/моль. В каком направлении реакция идет самопроизвольно при стандартных условиях? Каково значение константы равновесия?
19. Сделать заключение о практической обратимости реакции АТФ+АМФ↔2АДФ при 310 К, если ∆G 0 = -2,10 кДж/моль.
20. В печени протекает ферментативный обратимый процесс:
При 37 0 С равновесная концентрация глюкозо-1-фосфата 0,001 моль/л, а глюкозо-6-фосфата – 0,019 моль/л. Рассчитать Кравн.
источник