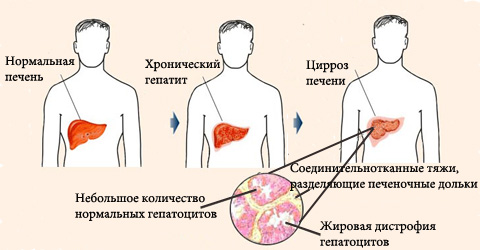
Цирроз печени – состояние сопровождающееся поражением печеночных клеток в результате аутоиммунного токсического или вирусного влияния на ткани железы. Развитие патологии сопровождается развитием в организме больного целого комплекса различных печеночных синдромов.
Наиболее частой причиной развития цирроза является инфицирование гепатитом С или злоупотребление алкоголем. При указанных патологиях разрушение печени начинается задолго до появления первых характерных признаков.
При циррозе печени у больного можно выявить разнообразные симптоматические комплексы, основными среди которых являются следующие:
- Астеновегетативный.
- Цитолиз.
- Иммуновоспалительный.
- Холестаз.
- Диспепсический.
- Геморрагический.
- Портально-гипертензионный синдром.
- Синдром печеночно-клеточной недостаточности.
- Гепаторенальный синдром.
Синдромы при циррозе печени чаще всего начинают проявляться на субкомпенсированной и декомпенсированной стадиях.

На протяжении некоторого периода прогрессирования течение ЦП происходит практически бессимптомно. Но клинически очерченный период отличается тем, что могут быть выявлены в разных сочетаниях разнообразные синдромы поражения печени.
В некоторых случаях синдромы цирроза печени могут проявляться отдельными признаками, входящими в их состав, при этом спектр таких симптомов может в каждом конкретном случае быть индивидуальным.
Астеновегетативный синдром проявляется общей слабостью, быстрой утомляемостью, раздражительностью, бессонницей. Все указанные признаки не исчезают у пациентов на протяжении всего периода развития патологического процесса.
Помимо этого у больного наблюдается появление зябкости и повышение потоотделения, также у пациента учащается пульс. Указанные симптомы могут быть начальным проявлением большинства психических заболеваний, помимо этого такая ситуация наблюдается при развитии неврозов и психопатий.
Астеновегетативный синдром проявляется дополнительно в нарушениях функционирования желудочно-кишечного тракта, сердечно-сосудистой системы и органов дыхания.
Больные испытывают при развитии синдрома дискомфортные ощущения и боли во всем организме. У пациентов появляется повышенная чувствительность кожных покровов к действию различных раздражителей.
Органы чувственного восприятия становятся особенно чувствительными. Такая чувствительность связана с возникновением временного поражения участков нервной системы, проявляющегося нестабильностью осуществления процесса передачи нервных импульсов и реакций на раздражители.
Такие нарушения приводят к появлению некоторого ступора во взаимодействии организма с внешней средой. Для нормализации восприятия окружающей среды организму требуется период временной адаптации.

При проведении и диагностировании наличия этого синдрома, особое внимание уделяется лабораторным показателям АлАТ и АсАТ, а именно степени роста концентрации.
При наличии концентрации этих компонентов в 5 и меньше раз превышающей нормальное содержание, то синдром расценивается как умеренно-выраженный. Превышение нормального содержания в 5-10 раз свидетельствует о развитии синдрома средней тяжести, в случае выявления количества печеночных ферментов в концентрации в 10 и более раз превышающую нормальное содержание, врачи говорят о наличии выраженного синдрома, имеющего высокую степень тяжести.
Цитолитический синдром характеризуется снижением гиперферментии на порядок ниже, чем при хроническом вирусном гепатите, что обусловлено резким снижением синтетической функции печени.

Гепаторенальный синдром заключается в том, что в процессе развития патологического состояния происходит не только поражение печеночной ткани, но и нарушается нормальная работа почек.
При развитии синдрома в тяжелой форме может возникать почечная недостаточность.
В соответствии с данными статистики около 1/5 всех больных, у которых выявлено поражение печени, в дальнейшем страдают от появления вторичного поражения почек.
В соответствии с исследованиями наиболее часто развитие этого синдрома обусловлено:
- инфекционными заболеваниями;
- отравлениями лекарственными средствами;
- послеоперационными осложнениями при проведении хирургического вмешательства на желчных путях;
- операционными вмешательствами на сердце.
В настоящий момент патогенез нарушений функций почечной системы на фоне развития цирроза печени является недостаточно изученным и достоверно не известна причина и взаимосвязь такого патологического процесса. Исследующие эту проблематику врачи выдвигают гипотезу о том, что значительную роль в нем играет общее нарушение процессов кровообращения в системе почек и непосредственное воздействие на почки различных антител, метаболитов и иммунных комплексов, продуцируемых организмом при прогрессировании цирроза.
Во врачебной практике различают два типа синдрома.
Для первого типа характерно отсутствие внешних признаков и он выявляется при проведении дополнительных обследований. В анализе мочи регистрируется:
- Повышенное количество белка.
- Увеличение количества лейкоцитов, эритроцитов и гиалиновых цилиндров.
При проведении биохимии крови выявляется повышенное содержание печеночных ферментов. При этом все основные функции системы почек и печени не страдают.
Второй тип характеризуется:
- сильной утомляемостью;
- снижением работоспособности;
- появлением болевых ощущений в области поясницы и брюшной полости;
- возникновением мигрени;
- формированием отечности конечностей;
- появлением высыпаний на коже.
Лабораторные анализы выявляют повышение уровня креатинина и азота в крови. Исследования регистрируют нарушение функций почек.
Проведение комплексного лечения способствует восстановлению функциональных возможностей почек и печени.

Прогрессирование патологического состояния сопровождается возникновением расширения вен, формированием гематом и появлением склонности к образованию синяков. В некоторых случаях патологическое состояние может сопровождаться маточными кровотечениями и кровотечением пищевода, также возможно частое появление кровотечений из носа и десен.
Появление кровотечений обусловлено тем, что нарушается функция печени, обеспечивающая выработку некоторых факторов свертываемости крови. Особенно опасным является возникновение такого синдрома у беременной женщины перед родами, такая ситуация может грозить большими кровопотерями и наступлением летального исхода.
Развитие геморрагического синдрома наблюдается у половины больных циррозом, при этом около 25% погибают от возникновения желудочно-кишечных кровотечений.
Наиболее характерными признаком внутреннего кровотечения является появление рвоты с примесью крови и появление спустя некоторое время жидкого стула.
Терапия при выявлении признаков развития синдрома направлена на профилактику кровотечений и тромбозов, а также на быстрое их устранение.

Независимо от того что стало причиной развития цирроза – воспаление в результате инфекции, отравление, токсическими соединениями или негативное воздействие алкоголя, наблюдается изменение в портальной системе проявляющееся повышением давления крови. Основные патологические изменения являются внепеченочными и происходят в воротной вене или в одной из ее основных ветвей.
Диагностирование умеренной портальной гиперплазии осуществляется при повышении давления от 150 до 300 мм вод. ст. Одновременно с таким подъемом давления у больного наблюдается появление диареи и тошноты.
При подъеме давления выше показателя в 300 мм вод. ст. в портальной системе, врачи диагностируют признаки развития варикозного расширения вен. Изменения в венозной части кровеносной системы желудка и пищевода приводят к появлению кровотечений.
Признаками такого патологического состояния являются:
- Пониженное АД.
- Появление рвоты с кровью.
- Появление черного кала.
- Развитие анемии.
- Увеличение количества сердечных сокращений до 100 ударов в минуту.
Последствие развития синдрома является скопление жидкости в брюшной полости. Это вызвано нарушением процесса оттока крови в печени и повышением давления в кровеносной системе.
Основными объективными асцитическими признакам и являются:
- визуализация венозных коллатералей;
- резкое увеличение массы тела;
- появление тяжести и давления в желудке;
- появление тошноты и головокружений;
- отечность нижних конечностей;
- уплощение околопупочной области живота;
- образование пупочной грыжи;
- кровяные выделения из анального отверстия.
В результате накопления жидкости у больного может возникнуть заражение брюшной стенки – перитонит.
Синдром малых печеночных признаков или малой печеночно-клеточной недостаточности характеризуется появлением сосудистых звездочек на кожных покровах в верхней части туловища.
Помимо этого у больного наблюдается пальмарная эритема – яркая красная окраска ладошек в области тенара, гипотенара и фаланг пальцев. У больного выявляется также комплекс патофизиологических изменений в виде карминово-красной окраски губ и гинекомастии у взрослых мужчин, атрофических процессов в половых органах и снижения степени выраженности вторичных половых признаков.
В результате развития венозного застоя у больного наблюдается увеличение размера селезенки и развитие гиперплазии ткани ретикулогистиоцитарной ткани селезенки. Дополнительно в железе наблюдается разрастание фиброретикулярной ткани и формирование артериовенозных шунтов. Процесс сопровождается появлением тяжести и болей в левом боку.
Острая форма патологии приводит к возникновению гиперспленизма, представляющего собой повышенное разрушение форменных элементов крови в селезенке, которое сопровождается появлением панцитопении, а также астенического и геморрагического синдромов.

При проведении терапии цирроза основная рекомендация врачей заключается в устранении нежелательного воздействия на организм. После выполнения этого требования приступают к лечению основной патологии. Для восстановления работы печени применяются препараты группы гепатопротекторов.
Наиболее распространенными средствами, применяемыми при проведении медикаментозной терапии, являются:
- Эссенциале;
- Эссенциале Форте.
- Карсил и некоторые другие.
В случае необходимости проводится процедура трансплантации печени.
Проведение медикаментозной терапии цирроза и провоцируемых им синдромов, может осуществляться смешанным методом, при комплексном использовании медикаментов и средств народной медицины. Такие препараты рекомендуется применять после проведения консультации с лечащим врачом. Наиболее распространенными народными средствами являются препараты, приготовленные на основе расторопши.
источник
Печеночно-почечный синдром определяется как прогрессирующая олигурическая почечная недостаточность на фоне хронических и острых болезней печени при отсутствии других известных клинических или патологических причин для почечной недостаточности. Печеночно-почечный синдром характеризуется острым сужением сосудов наиболее ярко выраженным в корковых областях почек. Печеночно-почечный синдром при циррозе рассматривается как крайняя степень патофизиологического развития болезни, ведущая к удержанию ионов натрия и воды у больных.
Одной из основных причин печеночно-почечного синдрома является дисбаланс между внутрипочечным сужением и расширением сосудов. Его патогенез определяется гемодинамическими изменениями и нарушением прямых печеночно-почечных связей. Последнее включает в себя гепаторенальный рефлекс, который активируется разрушением гепатоцитов, увеличением внутрисинусоидального давления, что ведет к значительному снижению клубочковой фильтрации. Более того, снижение скорости образования в печени мочегонных факторов также может оказывать свое влияние, однако эти факторы пока еще не полностью идентифицированы. Гемодинамические изменения характеризуются периферическим расширением сосудов, что частично происходит в результате увеличения образования оксида азота вследствие эндотоксемии. Для поддержания кровяного давления расширение сосудов балансируется активацией симпатической нервной и различных гуморальных систем, регулирующих давление внутри организма. Все это одновременно является пусковым механизмом задержки ионов натрия и воды. В результате возникает гипердинамическая циркуляция, однако компенсаторные механизмы, очевидно, недостаточно эффективны для того, чтобы противостоять расширению сосудов и поэтому сохраняется ретенция натрия и воды. Таким образом, печеночно-почечный синдром имеет полное сходство с преренальной азотемией.
Печеночно-почечный синдром развивается при дальнейшем прогрессировании ренальной вазоконстрикции в результате уменьшения внутрисосудистого объема после парацентеза, кровотечений, больших доз диуретиков и, например, при длительном применении нестероидных противовоспалительных препаратов. Клинически печеночно-почечный синдром характеризуется олигурией, концентрированной, почти лишенной натрия, мочой на ранних стадиях без нарушений в моче количества элементов седиментации.
Таким образом, печеночно-почечный синдром имеет сходство с преренальной азотемией (уремией) и отличается от последней потерей улучшения функциональной способности почек после восстановления объема плазмы крови. Большинство больных циррозом печени при печеночно-почечного синдрома без экстренного соответствующего лечения погибают.
Стойкая, не исчезающая при коррекции гиповолемии, функциональная почечная недостаточность у больных циррозом печени — гепаторенальный синдром (печеночная нефропатия) — развивается чаще всего на фоне нарастающего и резистентного к лечению асцита, резко нарушенной функции печени, значительно выраженной задержки воды, гипонатриемии и значительного снижения содержания натрия в моче в результате нарушенной его экскреции почками. Печеночно-почечный синдром является следствием остро нарастающей гиповолемии — при кровотечении, рвоте, диарее, септицемии, эвакуации большого объема асцитической жидкости при парацентезе или чрезмерном диурезе при передозировке мочегонных средств. Аналогичный синдром со стойкой азотемией имеет место при фульминантной (молниеносной) печеночной недостаточности у больных с острым и подострым некрозом печени. У этих больных, а не у больных циррозом, целесообразно проводить гемодиализ. Печеночно-почечный синдром следует отличать от частых при циррозе печени эпизодов обратимой преренальной азотемии с метаболическим алкалозом, которые могут повторяться в течение нескольких лет из-за снижения объема крови при рвоте, диарее, полиурии или желудочно-кишечном кровотечении. В терминальной стадии цирроза печени печеночно-почечный синдром развивается у 80% больных, однако основной причиной смерти является не почечная недостаточность, а печеночная кома.
Как уже указывалось, в основе гепаторенального синдрома лежит почечная вазоконстрикция, главным образом в наружном слое корковой зоны почек (наружная кортикальная ишемия). Как следствие этого, возникает резкое снижение почечного кровотока и гломерулярной фильтрации и дальнейшее уменьшение выделения натрия почками при нормальной способности к канальцевой реабсорбции.
Печеночно-почечный синдром проявляется постепенным нарастанием в плазме крови содержания креатинина (> 212 мкмоль/л) и мочевины (> 8,3 мкмоль/л, иногда до 33 мкмоль/л), олигурией ( 40 ммоль, но всегда > 12 ммоль за сут. (соотношение осмолярность мочи и осмолярность плазмы 1:1). Важно также иметь в виду, что у 60-85% больных циррозом печени (чаще алкогольным) развивается нефропатия, обусловленная отложением в мезангии почечных клубочков иммуноглобулинов, в основном за счет IgA, в сочетании с С 3 — компонентом комплемента, так называемая IgA-нефропатия. Это осложнение обычно протекает клинически латентно и не сопровождается хронической почечной недостаточностью или артериальной гипертонией. Однако у 1/4 больных отмечаются изменения мочи, соответствующие изменениям при гломерулонефрите или при нефротическом синдроме, в единичных случаях наблюдается массивная гематурия. Цирроз печени нередко может сочетаться с хроническим пиелонефритом.
Мера профилактики печеночно-почечного синдрома при циррозе печени — тщательное устранение факторов, которые могут способствовать гиповолемии: строгий контроль за применением диуретических препаратов, эвакуацией больших количеств асцитической жидкости при парацентезах, дозой нестероидных противовоспалительных средств, борьба с инфекционными осложнениями и экстренные мероприятия для остановки кровотечений.
При печеночно-почечном синдроме следует ограничить введение белка до 0,5 г/кг (при таком режиме отрицательный азотистый баланс не развивается), ионов натрия и воды до 800-1000 мл/сут., так как для больных с почечной недостаточностью свойственно резкое снижение способности выделять жидкость, вследствие чего развивается гипонатриемия разведения и гипоосмолярность плазмы. Эффективно введение 5% р-ра глюкозы, подавляющей распад белка, особенно при белковом голодании. Рекомендовано сочетать инфузии альбумина по 50 г каждые 2 ч и 20% р-ра маннитола по 150 мл каждые 2 ч и далее — назначение фуросемида и антагонистов альдостерона (спиронолактона). При отсутствии эффекта прибегают к назначению орнитин-вазопрессина (25 ЕД через 12 ч и допамина 100 мг через 12 ч). Если и эти лечебные мероприятия при печеночно-почечном синдроме оказываются неэффективными, необходима трансплантация печени или наложение трансюгулярного (трансшейного) внутрипеченочного портосистемного стент-шунта (TIPS). Ввиду того что аргинин, как составляющий компонент цитраргинина, является донатором оксида азота, его применение может усугубить почечную недостаточность при печеночно-почечном синдроме.
Асцит-перитонит относится к тяжелейшим осложнениям портальной гипертензии с отечно-асцитическим синдромом. Он развивается вследствие спонтанного инфицирования асцитической жидкости возбудителями кишечного происхождения или при парентеральном попадании инфекции в организм.
Бактериальные инфекции являются частыми осложнениями у пациентов с портальной гипертензией, особенно у больных с циррозом. Среди них спонтанный бактериальный перитонит является наиболее известным и часто встречающимся в клинической практике, так как он широко распространен и ассоциируется с высоким уровнем смертности. Патофизиология спонтанного бактериального перитонита не полностью ясна, но скорее всего он возникает в связи с переходом бактерий из кишечного просвета в мезентериальные брыжеечные лимфатические узлы — феномен известный как бактериальная транслокация, системная циркуляция бактерий и в конечном итоге — переход их в асцитическую жидкость.
Асцит-перитонит наблюдается у 7-8% больных декомпенсированным циррозом печени. Летальность при этом осложнении, достигающую 80-100%, можно значительно снизить при своевременном диагнозе и проведении срочной антибактериальной терапии.
При бактериологическом исследовании чаще всего высевают Е. albi, а также стрептококки, Klebsiella, стафилококки и протей. Характерными симптомами являются абдоминальная боль, болезненность при пальпации живота, лихорадка, парез кишок с исчезновением шума кишечной перистальтики, зачастую без симптомов раздражения брюшины, в гемограмме — лейкоцитоз. У больных с асцитом-перитонитом прогрессирующе нарастают явления печеночной энцефалопатии, часто развиваются сепсис, острые кровотечения из вен пищевода и желудка, гепаторенальный синдром. Асцитическая жидкость, полученная при диагностическом парацентезе, более чем у 70% больных мутная, содержит > 400 лейкоцитов в 1 мкл, 15-80% которых представлены полиморфно-ядерными лейкоцитами, повышена концентрация лактата в асцитической жидкости.
При асците-перитоните необходимо экстренное назначение антибиотиков широкого спектра действия после диагностической пункции живота для бактериологического исследования асцитической жидкости.
Спонтанный бактериальный перитонит является мономикробной инфекцией, как правило, вызываемой грамнегативными бактериями. Цефалоспорины третьего поколения являются одним из вариантов лечения для пациентов со спонтанным бактериальным перитонитом, хотя последние исследования дают основание считать, что хинолоны (офлоксацин, ципрофлоксацин) также весьма эффективны при пероральном применении. При употреблении этих антибиотиков излечиваются 80-90% пациентов. Несмотря на высокий уровень излечиваемости, смертность очень высока (20-40%), что оправдывает использование профилактических мер у пациентов, имеющих предрасположенность к этому виду осложнений. Определены несколько подгрупп больных циррозом печени, которые представляют более высокий риск для развития асцита-перитонита:
источник
Нефротический синдром – это симптомокомплекс, развивающийся на фоне поражения почек, включающий массивную протеинурию, нарушения белково-липидного обмена и отеки. Патология сопровождается гипоальбуминемией, диспротеинемией, гиперлипидемией, отеками различной локализации (вплоть до анасарки и водянки серозных полостей), дистрофическими изменениями кожи и слизистых. В диагностике важную роль играет клинико-лабораторная картина: изменения в биохимических анализах крови и мочи, ренальная и экстраренальная симптоматика, данные биопсии почки. Лечение нефротического синдрома консервативное, включающее назначение диеты, инфузионной терапии, диуретиков, антибиотиков, кортикостероидов, цитостатиков.
Нефротический синдром может развиваться на фоне широкого круга урологических, системных, инфекционных, хронических нагноительных, метаболических заболеваний. В современной урологии данный симптомокомплекс осложняет течение заболеваний почек примерно в 20% случаев. Патология чаще развивается у взрослых (30-40 лет), реже у детей и пожилых пациентов. Наблюдается классическая тетрада признаков: протеинурия (свыше 3,5 г/сут.), гипоальбуминемия и гипопротеинемия (менее 60-50 г/л), гиперлипидемия (холестерин более 6,5 ммоль/л), отеки. При отсутствии одного или двух проявлений говорят о неполном (редуцированном) нефротическом синдроме.
По происхождению нефротический синдром может быть первичным (осложняющим самостоятельные заболевания почек) или вторичным (следствием заболеваний, протекающих с вторичным вовлечением почек). Первичная патология встречается при гломерулонефрите, пиелонефрите, первичном амилоидозе, нефропатии беременных, опухолях почек (гипернефроме).
Вторичный симптомокомплекс может быть обусловлен многочисленными состояниями: коллагенозами и ревматическими поражениями (СКВ, узелковым периартериитом, геморрагическим васкулитом, склеродермией, ревматизмом, ревматоидным артритом); нагноительными процессами (бронхоэктазами, абсцессами легких, септическим эндокардитом); болезнями лимфатической системы (лимфомой, лимфогранулематозом); инфекционными и паразитарными заболеваниями (туберкулезом, малярией, сифилисом).
В ряде случаев нефротический синдром развивается на фоне лекарственной болезни, тяжелых аллергозов, отравлений тяжелыми металлами (ртутью, свинцом), укусов пчел и змей. Иногда, преимущественно у детей, причину нефротического синдрома выявить не удается, что позволяет выделить идиопатический вариант заболевания.
Среди концепций патогенеза наиболее распространенной и обоснованной является иммунологическая теория, в пользу которой свидетельствует высокая частота возникновения синдрома при аллергических и аутоиммунных заболеваниях и хороший отклик на иммуносупрессивную терапию. При этом образующиеся в крови циркулирующие иммунные комплексы являются результатом взаимодействия антител с внутренними (ДНК, криоглобулинами, денатурированными нуклеопротеидами, белками) или внешними (вирусными, бактериальными, пищевыми, медикаментозными) антигенами.
Иногда антитела образуются непосредственно к базальной мембране почечных клубочков. Осаждение иммунных комплексов в ткани почек вызывает воспалительную реакцию, нарушение микроциркуляции в клубочковых капиллярах, развитие повышенной внутрисосудистой коагуляции. Изменение проницаемости клубочкового фильтра при нефротическом синдроме ведет к нарушению абсорбции белка и его попаданию в мочу (протеинурия).
Ввиду массивной потери белка в крови развивается гипопротеинемия, гипоальбуминемия и тесно связанная с нарушением белкового обмена гиперлипидемия (повышение холестерина, триглицеридов и фосфолипидов). Появление отеков обусловлено гипоальбуминемией, снижением осмотического давления, гиповолемией, уменьшением ренального кровотока, усиленной продукцией альдостерона и ренина, реабсорбцией натрия.
Макроскопически почки имеют увеличенные размеры, гладкую и ровную поверхность. Корковый слой на разрезе бледно-серый, а мозговой — красноватый. Микроскопическое изучение тканевой картины почки позволяет увидеть изменения, характеризующие не только нефротический синдром, но и ведущую патологию (амилоидоз, гломерулонефрит, коллагенозы, туберкулез). Собственно нефротический синдром в гистологическом плане характеризуется нарушениями структуры подоцитов (клеток капсулы клубочков) и базальных мембран капилляров.
Признаки нефротического синдрома однотипны, несмотря на различие вызывающих его причин. Ведущим проявлением служит протеинурия, достигающая 3,5-5 и более г/сутки, причем до 90% выводимого с мочой белка составляют альбумины. Массивная потеря белковых соединений вызывает снижение уровня общего сывороточного белка до 60-40 и менее г/л. Задержка жидкости может проявляться периферическими отеками, асцитом, анасаркой (генерализованным отеком подкожной клетчатки), гидротораксом, гидроперикардом.
Прогрессирование нефротического синдрома сопровождается общей слабостью, сухостью во рту, жаждой, потерей аппетита, головной болью, тяжестью в пояснице, рвотой, вздутием живота, поносом. Характерным признаком служит олигурия с суточным диурезом менее 1 л. Возможны явления парестезии, миалгия, судороги. Развитие гидроторакса и гидроперикарда вызывает одышку при движении и в покое. Периферические отеки сковывают двигательную активность больного. Пациенты вялые, малоподвижные, бледные; отмечают повышенное шелушение и сухость кожи, ломкость волос и ногтей.
Нефротический синдром может развиваться постепенно или бурно; сопровождаться менее и более выраженной симптоматикой, что зависит от характера течения основного заболевания. По клиническому течению различаются 2 варианта патологии – чистый и смешанный. В первом случае синдром протекает без гематурии и гипертензии; во втором может принимать нефротически-гематурическую или нефротически-гипертоническую форму.
Осложнениями нефротического синдрома могут стать периферические флеботромбозы, вирусные, бактериальные и грибковые инфекции. В отдельных случаях наблюдается отек мозга или сетчатки, нефротический криз (гиповолемический шок).
Ведущими критериями распознавания нефротического синдрома служат клинико-лабораторные данные. Объективный осмотр выявляет бледные («перламутровые»), холодные и сухие на ощупь кожные покровы, обложенность языка, увеличение размеров живота, гепатомегалию, отеки. При гидроперикарде отмечается расширение границ сердца и приглушение тонов; при гидротораксе – укорочение перкуторного звука, ослабленное дыхание, застойные мелкопузырчатые хрипы. На ЭКГ регистрируется брадикардия, признаки дистрофии миокарда.
В общем анализе мочи определяется повышенная относительная плотность (1030-1040), лейкоцитурия, цилиндрурия, наличие в осадке кристаллов холестерина и капель нейтрального жира, редко – микрогематурия. В периферической крови – увеличение СОЭ (до 60-80 мм/ч), преходящая эозинофилия, увеличение числа тромбоцитов (до 500-600 тыс.), небольшое снижение уровня гемоглобина и эритроцитов. Нарушение свертываемости, выявляемые с помощью исследования коагулограммы, могут выражаться в небольшом повышении или развитии признаков ДВС-синдрома.
Исследование биохимического анализа крови подтверждает характерную гипоальбуминемию и гипопротеинемию (менее 60-50 г/л), гиперхолестеринемию (холестерин более 6,5 ммоль/л); в биохимическом анализе мочи определяется протеинурия свыше 3,5 г в сутки. Для выяснения степени выраженности изменений почечной ткани может потребоваться проведение УЗИ почек, УЗДГ почечных сосудов, нефросцинтиграфии.
С целью патогенетической обоснованности лечения нефротического синдрома крайне важно установление причины его развития, в связи с чем требуется углубленное обследование с выполнением иммунологических, ангиографических исследований, а также биопсии почки, десны или прямой кишки с морфологическим исследованием биоптатов.
Терапия проводится стационарно под наблюдением врача-нефролога. Общими лечебными мероприятиями, не зависящими от этиологии нефротического синдрома, служат назначение бессолевой диеты с ограничением жидкости, постельного режима, симптоматической лекарственной терапии (диуретиков, препаратов калия, антигистаминных средств, витаминов, сердечных средств, антибиотиков, гепарина), инфузионное введение альбумина, реополиглюкина.
При неясном генезе, состоянии, обусловленном токсическим или аутоиммунным поражением почек, показана стероидная терапия преднизолоном или метилпреднизолоном (перорально или внутривенно в режиме пульс-терапии). Иммуносупрессивная терапия стероидами подавляет образование антител, ЦИК, улучшает почечный кровоток и клубочковую фильтрацию. Хорошего эффекта лечения гормонорезистентного варианта патологии позволяет добиться цитостатическая терапия циклофосфамидом и хлорамбуцилом, проводимая пульс-курсами. В период ремиссии показано лечение на специализированных климатических курортах.
Течение и прогноз тесно связаны с характером развития основного заболевания. В целом устранение этиологических факторов, своевременное и правильное лечение позволяет восстановить функции почек и достичь полной стабильной ремиссии. При неустраненных причинах синдром может принимать персистирующее или рецидивирующее течение с исходом в хроническую почечную недостаточность.
Профилактика включает раннее и тщательное лечение почечной и внепочечной патологии, которая может осложниться развитием нефротического синдрома, осторожное и контролируемое применение лекарственных средств, обладающих нефротоксическим и аллергическим действием.
источник
РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Клинические протоколы МЗ РК — 2014
Так как понятие «синдром» еще не является диагнозом, то каждый случай нефротического синдрома требует проведения тщательного поиска возможных его причин, верификации морфологического варианта поражения почек и установления морфологического/клинического диагноза с последующим обоснованным лечения уже доказанного диагноза, а не синдрома.
Гломерулярные нарушения при подостром бактериальном эндокардите (I33.0+)
• другие пролиферативные гломерулонефриты.
• другие: преэклампсия, ПМР, IgА-нефропатия, стеноз почечной артерии (редко).
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
• КТ грудного, брюшного сегментов.
иммунофлюоресценция: с набором реагентов первичных антител меченных флюорохромом;
Аллергические реакции на контрастные вещества, вакцины.
Физикальное обследование:
Инструментальные исследования:
Дифференциации требуют заболевания, которые протекают с выраженным отечным синдром: НС, цирроз печени, застойная хроническая сердечная недостаточность (ХСН).
Получить консультацию по медтуризму
Получить консультацию по медтуризму
Иммуносупрессивная терапия подразумевает монотерапию кортикостероидами, а при быстропрогрессирующем течении и находке полулуний при нефробиопсии требует проведения комбинированной иммуноспурессивной терапии. Кортикостероиды в дебюте в виде пульс-терапии 15мг/кг веса в/в капельно №3, затем внутрь в дозе 1мг/кг/сут 60 дней, затем 0,6мг/кг/сут 60 дней, затем 0,3мг/кг/сут 60дней + циклофосфамид 0,5мг/м2, в/в капельно ежемесячно в течение 6 месяцев. Во второй линии вместо циклофосфамида возможно применение микофеноловой кислоты в дозе 360-1440мг/сут в 2 приема или Мофетила микофенолата 500-2000мг/сут в 2 приема. (Не забывать тератогенное действие Микофенолата и микофеноловой кислоты и при планировании беременности отказаться от данной группы препаратов). 30.
Лечение гломерулярных поражений при новообразованиях – лечение проводится в специализированном онкологическом учреждении и направлено на устранение причины нефротического синдрома.
При пурпуре Шенлейн-Геноха лечение проводится в соответствии с морфологическим вариантом нефротического синдрома (см. лечение морфологических форм).
При резистентном НС ДН необходимо провести биопсию почки и определить морфологический вариант возможного иммуного гломерулярного поражения почек и назначить лечение соответственно морфологическому варианту поражения почек (лечение в зависимости от морфологического варианта см выше).
Лечение гломерулярных поражений при системных болезнях соединительной ткани:
Лицам фертильного возраста вместо Циклофосфамида предпочтительней использовать Ритуксимаб в дозе 375мг/м2, № 4 в/в капельно (после премедикации) еженедельно или по 1000мг в/в капельно (после премедикации) №2 с интервалом 2 недели.
— Гидрохлорохин 200-400мг внутрь 1 раз в день всем пациентам с СКВ при отсутствии противопоказаний.
АL-амилоидоз: целью терапии является снижение или элиминация плазмаклеточных клонов. Режимы терапии включают ЦФ, Талидомид и Дексаметазон (СТД-схема) или Мелфалан + Дексаметазон (М/Декс-схема). Ответ на терапию наблюдается в 30-50% случаях. Альтернативой является применение Бортезомиба 1,3 мг/м2 в дни 1, 4, 8 и 11 (циклы 1, 3 и 5), дексаметазон 40 мг внутрь в дни 1-4, 9-12, 17-20 (циклы 2, 4 и 6). При отсутствии успеха используется высокодозная химиотерапия с трансплантацией аутологичных стволовых клеток. При наступлении терминальной стадии ХБП – диализ. Трансплантация почки возможна только при достижении полной ремиссии плазмаклеточной дискразии, иначе ожидается рецидив в трансплантате.
специфическая терапия: Бортезомиб 1,3 мг/м2 в дни 1, 4, 8 и 11 (циклы 1, 3 и 5), дексаметазон 40 мг внутрь в дни 1-4, 9-12, 17-20 (циклы 2, 4 и 6). При безуспешной консервативной терапии показана пересадка аутологичных стволовых клеток.
− Обычно нет необходимости коррекции гиперлипидемии у стероидчувсвительных пациентов, так как она купируется после наступления ремиссии.
Начатую в стационаре патогенетическую терапию необходимо продолжить в амбулаторных и домашних условиях пациента под ежемесячным контролем результатов лабораторных данных (ОАК, ОАМ, Биохимический анализ крови), кроме того:
− При резистентности к проводимой иммуносупрессивной терапии проведение повторной биопсии почки в условиях стационара.
1. Инфекции. У пациентов с нефротическим синдромом могут быть разные инфекции: перитониты, целлюлиты, пневмония.
При наличии varicella zoster однократное введение иммуноглобулина 400мг/кг, внутривенно ацикловир (1500мг/м2/сут) 3 дня или внутрь 80мг/кг/сут 7-10 дней [16].
4. Побочные эффекты кортикостероидов: повышенный аппетит, задержка роста, риск инфекций, гипертензия, деминерализация костей, повышение глюкозы крови, катаракта
• эпоэтин-бета, шприц-тюбики по 2000МЕ.
• альфакальцидол драже 0,25мкг; 0,5мкг.
При почечной эклампсии – снижение АД, диазепам 1мл.
Другие виды лечения, оказываемые на этапе скорой неотложной помощи: не проводятся.
• профилактика эклампсии, сердечно-сосудистой недостаточности – пероральный прием антигипертензивных препаратов, лечебная физкультура.
источник
Цирроз печени – это состояние, при котором поражаются печеночные клетки вследствие аутоиммунного, токсического или вирусного воздействия на организм. Заболевание встречается повсеместно, проявляется желтушным синдромом, а также признаками повреждения ткани печени на УЗИ или МРТ, КТ. Самой частой причиной цирроза является гепатит С или алкоголизм. При этих патологиях печень начинает разрушаться еще задолго до появления симптоматики.
Цирроз имеет обширную клиническую картину в виде комплексов симптомов, которые условно объединяются в синдромы. Такая группировка помогает поставить точный диагноз, назначить необходимое лечение, а также правильно оказать первую медицинскую помощь. Цель статьи: ознакомить читателя с проявлениями синдромов при циррозе, выяснить их значимость для диагностики.
Для успешной терапии патологии важно понимать механизмы ее развития:
Чаще всего болезнь возникает чаще по причине вирусного поражения клеточных структур печени. Главными возбудителями, тропными к печеночной ткани, считаются вирусы гепатита А, В, С. При попадании вирусной частицы в кровь возбудитель мигрирует к печеночной ткани.
Для репликации возбудителю необходим готовый генетический материал гепатоцитов. Встраиваясь в геном печеночных структур, возбудитель создает новую РНК или ДНК, собирает вирусную частицу внутри клетки, а затем выходит из нее. После этого гепатоцит погибает.
Цирроз как следствие гепатита
При аутоиммунном механизме развития цирроза гепатоциты повреждаются вследствие нарушения работы иммунной системы. Т-лимфоциты ошибочно принимают собственные клетки печени за чужеродные, что приводит к запуску воспалительной реакции.
В очаг воспаления попадают цитокины, киллеры, макрофаги, разрушающие гепатоциты. Ткань печени постепенно замещается соединительной или жировой тканью. Без лечения у больного быстро развиваются симптомы печеночной недостаточности.
При циррозе можно обнаружить разнообразные симптомокомплексы, основные из которых описаны в таблице (Табл. 1).
Таблица 1 – Синдромы при циррозе
| Название синдрома | Специфические проявления |
|---|---|
| Астеновегетативный | Утомляемость, низкая производительность труда, плохое настроение, депрессия. |
| Цитолиз | Гипертермия, желтушность кожного покрова и склер, потеря веса, специфический запах изо рта, эритема на ладонях, сосудистые образования. |
| Иммуновоспалительный | Гипертермия, суставные боли, воспаление сосудистого русла кожи и легких, увеличение размеров селезенки, лимфатических узлов, миалгии. |
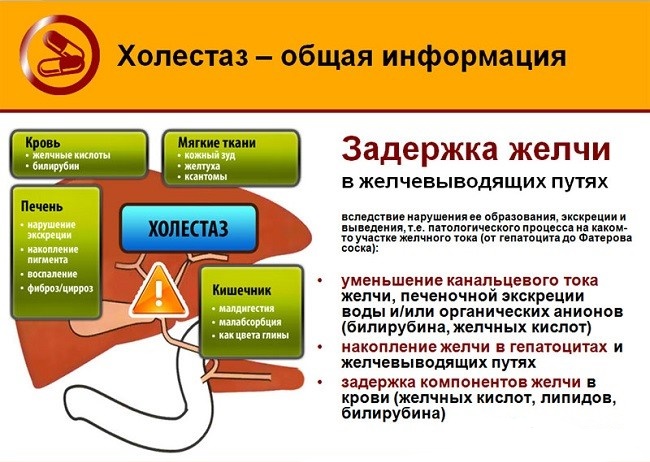
| Холестаз | Зуд кожного покрова, желтушность, появление пигментированных участков кожи, повышение температуры тела, темная моча, светлый кал (иногда). |
| Диспепсический | Метеоризм, неприятные ощущения в области желудка, отрыжка, тошнота, плохой аппетит, экстремально низкий вес, запоры. |
| Геморрагический | Кровотечения из носа, прямой кишки, десен, кровоизлияния на коже. |
| Портально-гипертензионный | Выпот в брюшной полости, увеличение селезенки, портокавальные анастомозы (пищеварительного тракта, коже живота («голова медузы»)) иногда сопровождаются кровопотерей. Увеличение селезенки проявляются – анемией, снижением лейкоцитов, тромбоцитов. |
| Печеночно-клеточная недостаточность | Энцефалопатия: депрессивный настрой, резкие смены настроения, изменение поведения, нарушение качества и режима сна, летаргический сон, сопор, тремор рук, коматозное состояние, отсутствие или ослабление рефлексов. |
| Гепаторенальный | Уменьшение или отсутствие мочи, увеличение объема выпота в брюшной полости, гипотония. |
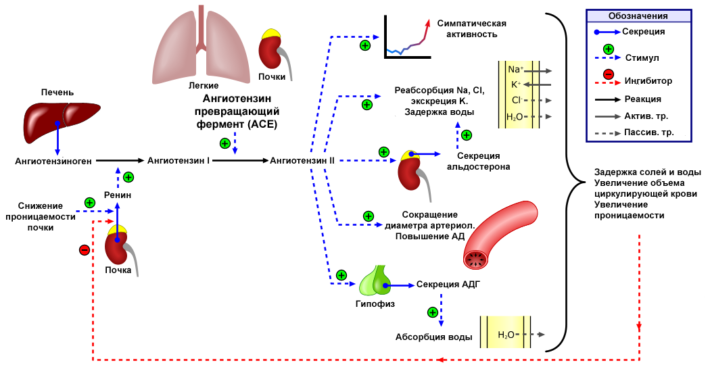
Гепаторенальный симптомокомплекс (ГРС) формируется на фоне печеночной недостаточности, расширения венозной сети печени. При циррозе увеличен уровень глюкагона крови, усиливается работа калиевых каналов, что приводит к расширению венозной системы печени. Давление начинает падать, развивается сильная гипотония.
Почки запускают работу ренин-ангиотензиновой системы, предназначенной для сохранения кровотока в почках. В результате работы этой системы почечные сосуды сильно сужаются для поддержания должного давления в канальцах, осуществления фильтрации крови в почках. При этом сохраняется минимальный диурез.
Если состояние больного сильно ухудшается, ренин-ангиотензиновая система все равно пытается сохранить кровоток в почках на фоне шокового состояния и очень низкого давления. В результате рефлекторно максимально сужаются сосуды, развивается почечная недостаточность.
У пациентов снижается диурез или вовсе прекращается образование мочи. Уровень креатинина и натрия крови повышается. При биохимическом исследовании у пациента увеличены АЛТ, АСТ, билирубин. Физикально синдром выражается в виде асцита. За счет этих показателей больному ставят диагноз «гепаторенального синдрома».
Выделяют 2 разновидности течения синдрома:
- Характеризуется более быстрым прогрессированием болезни (на протяжении 2 и менее недель). Показатель креатинина увеличивается вдвое, фильтрация в почках уменьшается на 50 %.
- Проявляется постепенно при развитии асцита.
Возможно молниеносное развитие 1 типа ГРС. Он может быть спровоцирован медицинскими манипуляциями, перитонитом, кровотечением, быстрым удалением жидкости из брюшной полости при асците.
Для понимания того, как развивается синдром, можно рассмотреть следующий клинический случай.
Больной 50 лет поступил в стационар с жалобами на желтушность кожного покрова, увеличение живота. В анализах крови отмечается увеличение показателей печеночных трансаминаз в 10 раз, билирубина – вдвое. При ультразвуковом обследовании обнаружили цирроз печени, большое количество жидкости, отечность ног, боли в области почек. Больному поставлен диагноз: цирроз печени. Асцит. Из анамнеза известно, что пациент страдает алкоголизмом на протяжении 20 лет.
Для облегчения состояния больного жидкость была удалена при помощи торакоцентеза, сразу было выведено 2 литра выпота. После процедуры больному стало хуже. Давление сильно упало, повысился креатинин крови. Диурез прекратился. Пациенту поставили диагноз гепаторенального синдрома на фоне цирроза печени.
Больному оказана первая помощь по восстановлению объема циркулирующей крови, назначен Допамин, который в дальнейшем сменили Терлипрессином. После купирования острого состояния пациенту назначены гепатопротекторы. На фоне лечения нормализовались показатели печеночных ферментов, снизился билирубин.
Данный синдром является следствием интенсивного разрушения гепатоцитов. Симптомокомплекс цитолиза может возникать при вирусном поражении клеток печени, аутоиммунных заболеваниях, алкогольной интоксикации на фоне имеющегося цирротического повреждения печеночной ткани. Клетки печени подвергаются некрозу, нарушается их оболочка, содержимое цитоплазмы начинает попадать в кровь.
Лабораторные исследования (биохимический анализ) подтверждают, что при синдроме цитолиза у пациента увеличиваются показатели печеночных ферментов (АЛТ, АСТ) в 10 и более раз, также повышаются показатели билирубина, щелочной фосфатазы. Однако наиболее показательными признаками цитолитического синдрома являются именно высокие значения АЛТ, АСТ.
Клиническая картина при синдроме цитолиза
Симптоматика является специфической и даже при визуальном осмотре позволяет диагностировать развитие синдрома. Клинические признаки у пациента, как правило, следующие:
- яркий желтушный цвет кожных покровов и слизистых;
- тяжесть в правом подреберье;
- увеличение размеров печени;
- печеночная эритема на коже ладоней;
- специфический запах изо рта;
- зуд кожи;
- появление сосудистого рисунка на кожном покрове (звездочки).
Рассмотрим клинический случай цитолиза для понимания механизма возникновения синдрома. Пациент, 34 года, страдает вирусным гепатитом С, поступил в стационар с жалобами на желтушный синдром, обострение гепатита С. У больного на УЗИ выявлены признаки цирроза печени, нарушение эхогенности ткани органа.
Лабораторно: увеличены АЛТ, АСТ в 10 раз, увеличение прямого билирубина вдвое, щелочная фосфатаза также повышена. Физикально: у пациента имеется желтушность кожи и склер, печень выступает на 3 см из-под реберного края, стул немного светлее нормы, моча цвета пива. На возвышенностях ладоней видна эритема.
Пациенту прописан Эссенциале внутривенно курсом на 10 суток. Затем больного перевели на таблетированные формы Эссенциале. Лактулоза была назначена для быстрого выведения билирубина из кишечника. На фоне терапии купирован желтушный синдром, нормализовались показатели АЛТ, АСТ, снизился билирубин.
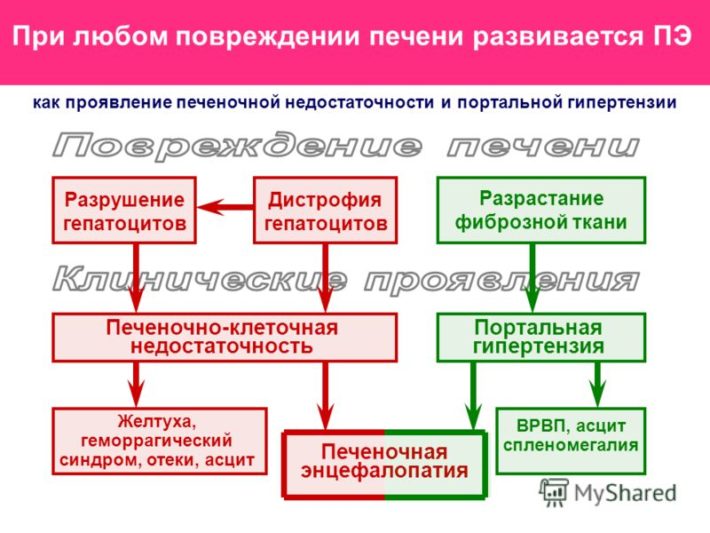
Симптомокомплекс печеночно-клеточной дисфункции является осложнением цирротического поражения печени. Клетки органа начинают отмирать, что приводит к его дисфункции. Гепатоциты не способны захватывать билирубин, поэтому он за короткий промежуток времени может сильно возрасти. Избыток билирубина токсичен для организма, особенно к нему чувствительны клетки головного мозга.
Клинические проявления повреждения печени
Сильный желтушный синдром способен привести к печеночной коме (энцефалопатии). У пациента может наблюдаться заторможенность реакции, снижение внимания, плохой сон. В тяжелых случаях человек впадает в сопор или кому. Рефлексы пациента снижены или отсутствуют. Показатель общего билирубина способен возрасти до 50 мкмоль/л и выше, альбумины снижаются до 27 г/л и ниже, протромбиновый индекс уменьшается в 2 и более раза. На стадии субкомпенсации и декомпенсации появляется асцит.
Таблица 2 – Стадии печеночно-клеточной недостаточности
| Стадия | Лабораторные данные |
|---|---|
| Компенсаторная |
|
| Субкомпенсаторная |
|
| Декомпенсаторная |
|
| Норма |
|
Пациент 27 лет с циррозом, асцитом поступил в стационар с жалобами на дискомфорт в правом подреберье, желтуху, заторможенность. Больному было проведено УЗИ печени, выявлены признаки цирроза. Из анамнеза известно, что у пациента имеется гепатит С. Лабораторно: увеличен билирубин до 48 мкмоль/л, альбумины снижены до 30 г/л, ПТИ уменьшен до 58 %. Больной заторможен, практически не реагирует на окружающих.
Желтушный синдром выражен ярко, склеры желтушные. Имеются признаки асцита: перкуторно обнаружен выпот в животе, уровни ее изменяются при смене положения пациента. По прошествии нескольких часов больной впал в кому. Билирубин на стадии декомпенсации составлял 60 ммоль/л.
Пациенту было назначена инфузионная терапия, гепатопротекторы внутривенно. Во время лечения к больному вернулось сознание, показатели билирубина снизились, альбумины повысились до нормы, ПТИ приблизился к 85%.
Кроме описанных выше синдромов, при циррозе могут развиваться и другие нарушения, в частности холестаз, портальная гипертензия, геморрагические проявления. Рассмотрим подробнее особенности этих синдромов.
Синдром застоя желчи формируется при закупорке или спазме желчных протоков. При этом желчные кислоты и билирубин под давлением попадают в кровь, просачиваясь через стенки протоков. Развивается тяжелый желтушный синдром.
У пациента наблюдается увеличение прямого билирубина крови, обнаруживается билирубин в моче. При осмотре больного склеры и кожный покров имеет желтушный цвет, кал обесцвечивается, моча имеет темный оттенок. При несвоевременной помощи возможно появление билирубиновой комы.
Пациент 45 лет поступил с диагнозом холестатического синдрома на фоне цирроза печени и панкреатита. Пациент жалуется на опоясывающие боли. У больного на УЗИ обнаружено увеличение головки поджелудочной железы, сдавление желчного протока, цирротическое повреждение печени. Лабораторно: увеличение непрямого билирубина, повышение амилазы, АЛТ и АСТ увеличены в 6 раз.
Больному назначены гепатопротекторы из группы эссенциальных фосфолипидов (Эссенциале), урсодезоксихолевой кислоты (Урсосан). Для купирования болевого синдрома назначен Трамадол. Больному показано введение альбуминов для лечения панкреатита. Прописана диетотерапия в целях снижения нагрузки на щитовидную железу, а также печень. На фоне лечения ушел болевой синдром, уменьшилась интенсивность желтухи, был купирован синдром холестаза.
Симптомокомплекс портальной гипертензии развивается после токсического, вирусного или алкогольного воздействия на уже поврежденную печеночную ткань. Заболевание проявляется расширением печеночных вен, анастомозов в области пищеварительного тракта, подкожных вен живота (голова медузы).
Часто при таком состоянии у больного возможны кровотечения из прямой кишки, пищевода, желудка, так как расширенная венозная сеть быстро повреждается. Многие больные вовремя не могут распознать наличие кровотечения в пищеварительном тракте самостоятельно. На фоне портальной гипертензии появляется анемия, увеличение селезенки. В биохимическом анализе крови повышаются показатели печеночных трансаминаз, билирубина, щелочной фосфатазы.
Этот синдром тесно связан с портальной гипертензией, так как нарушается функция селезенки. Образование эритроцитов, гемоглобина, тромбоцитов снижается. Анемия прогрессирует на фоне постоянных кровотечений и кровоподтеков. У пациента кровоточат десны, появляются гематомы на коже. Больные жалуются на кровь в кале или рвоту кровяным содержимым.
Клинический пример портальной гипертензии. Больной 48 лет страдает циррозом печени, алкоголизмом. После употребления большого количества алкоголя больного стало беспокоить увеличение живота, усиление венозного рисунка на животе. Отмечались кал, рвота с кровью.
При лабораторном обследовании наблюдается повышение ферментов (АЛТ, АСТ), билирубина. При клиническом анализе отмечается снижение гемоглобина, тромбоцитов. Во время проведения ультразвукового исследования у пациента обнаружено расширение воротной вены печени, признаки цирроза, увеличение селезенки.
Больному назначены эссенциальные фосфолипиды в терапевтических дозировках (1,8 г) внутривенно, а также кровоостанавливающая терапия для купирования кровотечений. Во время лечения у пациента прекратились кровотечения, а также улучшились показатели общего анализа крови, биохимии. По УЗИ размеры селезенки уменьшились, печеночная вена стала нормальных размеров.
Знание особенностей синдромов при циррозе помогает определиться с тактикой лечения, поставить точный диагноз, оценить состояние больного без анализов (при первичной диагностике). Симптомокомплексы отражают функцию печени. Высокая интенсивность их проявления является показанием для пересадки печени, что также важно для постановки в очередь для получения донорского органа.
Наиболее опасными считаются гепаторенальный, геморрагический, а также портально-гипертензионный симптомокомплексы. При их появлении при циррозе следует срочно обратиться к лечащему специалисту, так как промедление может привести к необратимым изменениям в печеночной ткани, почках, селезенке. Своевременная диагностика и терапия болезни поможет сохранить функцию органов.
источник